
【题目】合成药物中间体L的路线如图(部分反应条件或试剂略去):
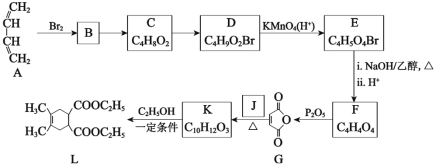
已知:I.最简单的Diels-Alder反应是![]()
II.![]()
III.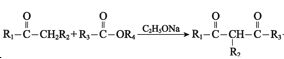 +R4OH
+R4OH
请回答下列问题:
(1)下列说法中正确的是____。
A.B→C的反应条件可以是“NaOH/H2O,△”
B.C→D的目的是实现基团保护,防止被KMnO4(H+)氧化
C.欲检验化合物E中的溴元素,可向其中滴加HNO3酸化的AgNO3溶液观察是否有淡黄色沉淀生成
D.合成药物中间体L的分子式是C14H20O4
(2)写出化合物J的结构简式____。
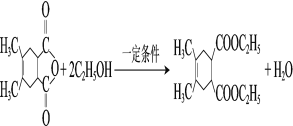
(3)写出K→L的化学方程式____。
(4)设计由L制备M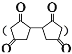 的合成路线(用流程图表示,试剂任选)____。
的合成路线(用流程图表示,试剂任选)____。
(5)写出化合物K同时符合下列条件的同分异构体的结构简式____。
①1H-NMR谱检测表明:分子中共有5种化学环境不同的氢原子;
②能发生水解反应;
③遇FeCl3溶液发生显色反应。
【答案】AB ![]()
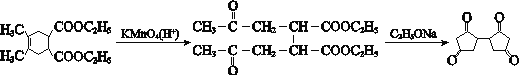
![]() 、
、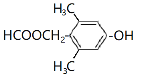 、
、 、
、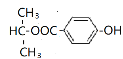 、
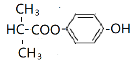
、
【解析】
A与溴发生1,4-加成生成B(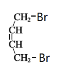 ),B在氢氧化钠水溶液加热条件下水解生成C(
),B在氢氧化钠水溶液加热条件下水解生成C(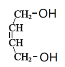 ),C与溴化氢加成生成D(
),C与溴化氢加成生成D(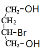 ),D被高锰酸钾氧化生成E(
),D被高锰酸钾氧化生成E(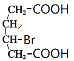 ),E在氢氧化钠醇溶液加热条件下水解生成F(
),E在氢氧化钠醇溶液加热条件下水解生成F(![]() ),F发生分子内脱水生成G(
),F发生分子内脱水生成G(![]() ),根据K的分子式推知J为
),根据K的分子式推知J为![]() ,G与J发生已知I的反应生成K(
,G与J发生已知I的反应生成K(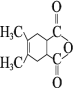 ),K与乙醇发生取代反应生成L。
),K与乙醇发生取代反应生成L。
(1)A.B→C的反应为卤代烃的水解,条件是“NaOH/H2O,△”,故A正确;
B.C→D的目的是为了保护碳碳双键,防止被KMnO4(H+)氧化,故B正确;
C.若要检验有机物分子结构中的卤族元素,则应先使其水解,后用HNO3酸化的AgNO3溶液,故C错误;
D.合成药物中间体L的分子式是C14H22O4,故D错误;
综上所述,答案为AB;
(2)由分析可知,J的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)K→L发生取代反应,其化学方程式为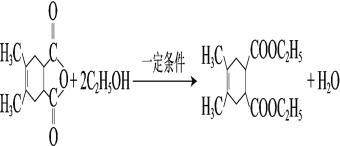 ,故答案为:
,故答案为: ;
;
(4)对比L的结构和目标产物的结构可推知,可先用高锰酸钾将碳碳双键氧化,发生已知II的反应,后在发生已知III的反应即可制备M ,其合成路线为
,其合成路线为 ,故答案为:
,故答案为: ;
;
(5)①1H-NMR谱检测表明:分子中共有5种化学环境不同的氢原子,说明分子结构比较对称;
②能发生水解反应,结合分子式可知分子结构中有酯基;
③遇FeCl3溶液发生显色反应,可知有苯环和酚羟基;
综上所述,符合条件的同分异构体的结构简式为![]() 、
、 、
、 、
、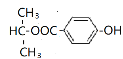 、
、 ;
;
故答案为:![]() 、
、 、
、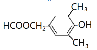 、
、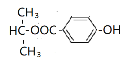 、
、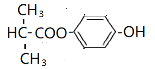 。
。


科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )

![]()
A. 两步反应均为吸热反应 B. 三种化合物的稳定性顺序:B﹤A﹤C
C. 加入催化剂不改变反应的焓变,但能提高转化率 D. 整个反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若将等物质的量的CO和H2混合气体充入恒温恒容密闭容器中进行反应:CO(g)+2H2(g)![]() CH3OH(g),下列事实能说明此反应已达到平衡状态的是( )
CH3OH(g),下列事实能说明此反应已达到平衡状态的是( )
A.容器内气体密度保持不变
B.用CO、H2、CH3OH表示反应的速率之比为1:2:1
C.单位时间内生成nmolCO的同时生成2nmolH2
D.混合气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将amolA与15molB的混合气体通入一固定体积为5L的密闭容器中,发生如下反应:A(g)+3B(g)![]() 2C(g)
2C(g)
(1)若反应进行到10min时达到平衡,n1(A)=13mol,n1(C)=6mol,;计算a的值___;这段时间内的C平均反应速率为___。
(2)反应达平衡时,B的转化率为分别为___;A的体积分数为___。
(3)下列操作能使该反应的反应速率增大的是___。
A.向密闭容器中通入氦气增大压强
B.增大A的浓度
C.适当升高温度
D.将容器的体积扩大至10L
(4)反应过程中容器内气体的密度是___(填“增大”、“减小”或“不变”,下同),平均相对分子质量是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究SO2和Fe(NO3)3溶液的反应原理,实验装置如图所示。实验中B装置内产生白色沉淀。
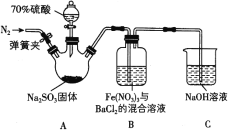
请回答下列问题:
(1)该实验过程中通入N2的时机及作用____。
(2)针对B装置内产生白色沉淀的原因,甲同学认为是酸性条件下SO2与Fe3+反应的结果,乙同学认为是酸性条件下SO2与NO3-反应的结果。请就B装置内的上清液,设计一个简单的实验方案检验甲同学的猜想是否正确:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() ,改变
,改变![]() 溶液的
溶液的![]() ,溶液中
,溶液中![]() 浓度的对数值
浓度的对数值![]() 与溶液
与溶液![]() 的变化关系如图所示。若
的变化关系如图所示。若![]() 。下列叙述错误的是( )
。下列叙述错误的是( )
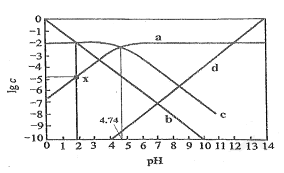
A. ![]() 时,
时,![]()
B. ![]() 电离常数的数量级为
电离常数的数量级为![]()
C. 图中点x的纵坐标值为![]()
D. ![]() 的
的![]() 约等于线c与线d交点处的横坐标值
约等于线c与线d交点处的横坐标值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56g铜粉加入100mL0.4mol·L-1的稀HNO3溶液中,加热充分反应后再加入100mL0.2mol·L-1的H2SO4溶液,继续加热,待充分反应后,所得溶液中Cu2+的物质的量浓度是(忽略溶液体积变化)( )
A.0.15mol·L-1B.0.2mol·L-1C.0.075mol·L-1D.0.45mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02mol CO2和0.01 mol CO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_____g。
(2)已知:2CO(g)+O2(g)==2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。则反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=_________kJ/mol。
CO2(g)+O(g)的△H=_________kJ/mol。
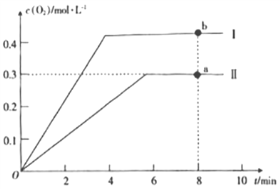
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图所示。

①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母)。
A.CO的体积分数保持不变 B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析上图,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=___(计算结果保留1位小数)。
③向2L的恒容密闭容器中充入2molCO2(g),发生反应: 2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后,c(O2)随时间的变化,则改变的条件是____;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后,c(O2)随时间的变化,则改变的条件是____;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量。
(1)写出该反应的热化学方程式_________。
(2)若1g水蒸气转化成液态水放热2.494kJ,则反应H2(g)+![]() O2(g)=H2O(l)的ΔH=_____kJ/mol。
O2(g)=H2O(l)的ΔH=_____kJ/mol。
(3)HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和NaOH反应的中和热的热化学方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com