
| A. | 在pH=4的溶液中,水所电离出的总的c(OH-)是10-10 mol•L-1 | |
| B. | 将pH=2的酸溶液和pH=12的碱溶液等体积混合后溶液的pH=7 | |
| C. | 将pH=4的盐酸和pH=4的醋酸分别与足量NaHCO3反应,后者产生CO2多 | |
| D. | 将pH=4醋酸和pH=10的氢氧化钠任意比例混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
分析 A.若pH=4的溶液为强酸弱碱盐溶液,则溶液中的氢离子是水电离的;
B.需要根据酸为强酸还是弱酸进行判断,混合液不一定为中性;
C.没有告诉盐酸盒醋酸溶液体积,无法判断二者产生的二氧化碳多少;
D.溶液中一定存在电荷守恒,根据混合液中的电荷守恒判断.
解答 解:A.在pH=4的溶液中,若溶质为酸溶液,则溶液中的氢氧根离子是水电离的,水所电离出的总的c(OH-)=10-10 mol•L-1,但是若溶质为强酸弱碱盐溶液,如氯化铵,其溶液中的氢离子是水电离的,则水所电离出的总的c(OH-)=10-4mol•L-1,故A错误;
B.将pH=2的酸溶液和pH=12的碱溶液等体积混合后,若酸为强电解质,则混合液的pH=7,当酸为弱酸时,混合液中酸过量,溶液显示酸性,溶液的pH<7,故B错误;
C.将pH=4的盐酸和pH=4的醋酸分别与足量NaHCO3反应,题中缺少溶液体积,无法判断产生CO2的多少,故C错误;
D.pH=4醋酸和pH=10的氢氧化钠任意比例混合,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,明确反应后溶质组成为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确电解质对水的电离的影响,能够根据电荷守恒、物料守恒等知识判断离子浓度大小.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和蔗糖互为同分异构体 | |
| B. | 青铜、硬铝和碳素钢都是合金 | |
| C. | 淀粉、蛋白质和花生油都是天然高分子化合物 | |
| D. | 发酵粉中含有小苏打,其主要成分为碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示,放电时左槽溶液逐渐由黄变蓝,下列有关说法正确的是( )
全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示,放电时左槽溶液逐渐由黄变蓝,下列有关说法正确的是( )| A. | 左槽的惰性电极为该电池的正极,右槽的电极反应式为V2+-e-=V3+ | |
| B. | 充电过程中H+由右槽定向移动到左槽 | |
| C. | 充电时阴极的电极反应式 VO2++2H++e-=VO2++H2O | |
| D. | 若充电时,左槽溶液中n(H+)的变化量为2mol,则反应转移的电子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,丙烯发生加聚反应得到的产物不能(填:“能”“不能”)使酸性KMnO4溶液褪色,丙烯分子中能够共平面的原子最多为7 个.
,丙烯发生加聚反应得到的产物不能(填:“能”“不能”)使酸性KMnO4溶液褪色,丙烯分子中能够共平面的原子最多为7 个.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
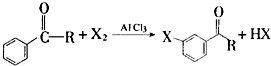


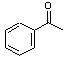 +Br2$\stackrel{AlCl_{3}}{→}$
+Br2$\stackrel{AlCl_{3}}{→}$ +HBr
+HBr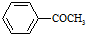 的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和
的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和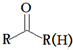 ,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
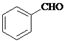 )和乙醇为原料合成苯乙酸乙酯,如图
)和乙醇为原料合成苯乙酸乙酯,如图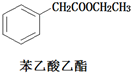 :
:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 工业上常用电解法制备元素C、D、E的单质 | |
| C. | 化合物AE、CE都是电解质,融化状态下能被电解 | |
| D. | 一定条件下,元素D、E的最高价氧化物对应的水化物之间不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是CDE.
(1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是CDE.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在顺反异构 | B. | 经加聚反应得树脂 | ||
| C. | 属于盐类 | D. | 使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酚酞试液 | B. | 氯化钡溶液 | C. | 氢氧化钠溶液 | D. | 硝酸银溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com