
 2NH3�Ѵﵽƽ��״̬����
2NH3�Ѵﵽƽ��״̬����| A��ȫ�� | B���٢ۢܢ� | C���ڢۢܢݢ� | D���ۢݢޢ� |


 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g)����һ�������´ﵽƽ�⣬���c(SO3)=0��04mol��L-1�����±�����ȷ����
2SO3(g)����һ�������´ﵽƽ�⣬���c(SO3)=0��04mol��L-1�����±�����ȷ����| A���������·�Ӧ��ƽ�ⳣ��Ϊ1��6��103 |
| B��ͨ������£��÷�Ӧһ�����Է����� |
| C����������£�O2��ת������20% |
| D������ϵ��SO2��SO3������֮����1:1ʱ����÷�Ӧ�ﵽ��ѧƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
 CH3OH��g������H�� ��
CH3OH��g������H�� �� CH3OH��g�� �������������䣬��300���500��ʱ�����ʵ���n��CH3OH���뷴Ӧʱ��t�ı仯������ͼ��ʾ���÷�Ӧ�ġ�H 0����>��<��=����
CH3OH��g�� �������������䣬��300���500��ʱ�����ʵ���n��CH3OH���뷴Ӧʱ��t�ı仯������ͼ��ʾ���÷�Ӧ�ġ�H 0����>��<��=����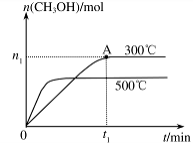
| A����������� |
| B�������¶� |
| C�������¶� |
| D��ʹ�ú��ʵĴ��� |
 CO+3H2��T��ʱ����1 L�ܱ�������Ͷ��1 mol CH4��1 mol H2O��g����5Сʱ���÷�Ӧ��ϵ�ﵽƽ��״̬����ʱCH4��ת����Ϊ50% ��������¶��µ�ƽ�ⳣ�� ���������С�������λ���֣���
CO+3H2��T��ʱ����1 L�ܱ�������Ͷ��1 mol CH4��1 mol H2O��g����5Сʱ���÷�Ӧ��ϵ�ﵽƽ��״̬����ʱCH4��ת����Ϊ50% ��������¶��µ�ƽ�ⳣ�� ���������С�������λ���֣���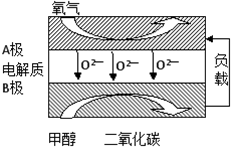
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3��˵������ȷ����
2SO3��˵������ȷ����| A��ֻҪѡ�����˵�������SO2��O2����ȫ��ת��ΪSO3 |
| B���÷�Ӧ�ﵽƽ���Ӧ����ȫֹͣ�ˣ������淴Ӧ����Ϊ�� |
| C������18Oԭ����ɵ�O2�μӷ�Ӧ��ƽ��ʱSO2��Ҳ�Ậ��18O |
| D���ڹ�ҵ�ϳ�SO3ʱ��Ҫͬʱ���Ƿ�Ӧ���ʺͷ�Ӧ�ܴﵽ��������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 I2(g)+H2(g)����H��0�����ƽ��ʱ�������Ϊ1L��c(I2)��0.5mol/L���ı�������������н�����ȷ����
I2(g)+H2(g)����H��0�����ƽ��ʱ�������Ϊ1L��c(I2)��0.5mol/L���ı�������������н�����ȷ����| A����������������䣬�����¶ȣ�����������ɫ���� |
| B�����£����ݣ�����һ���������������뷴Ӧ����������Ӧ���ʺ��淴Ӧ���ʾ����� |
| C�����£�����ѹ��������ʹ��������㶨Ϊ0.2L��һ��ʱ����c(I2)��2.5mol/L |
| D�����¡���ѹ����ͨ��2molHI���壬����ƽ��״̬��HIת���ʻ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Fe2O3(s)��CO(g)
Fe2O3(s)��CO(g)
 Fe(s)��CO2(g)����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����±�������˵������ȷ����( )
Fe(s)��CO2(g)����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����±�������˵������ȷ����( )| �¶�/�� | 1000 | 1150 | 1300 |
| ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
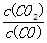
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4C(g)����ƽ��ʱc(A)=1.00mol?L-1���ֽ�ѹǿ��С��1.01��105Pa������ƽ���c(A)=0.18mol?L-1��������˵����ȷ���� ( )
4C(g)����ƽ��ʱc(A)=1.00mol?L-1���ֽ�ѹǿ��С��1.01��105Pa������ƽ���c(A)=0.18mol?L-1��������˵����ȷ���� ( )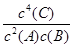
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 1/2N2(g)��CO2(g) ��H����373.4 kJ��mol��1
1/2N2(g)��CO2(g) ��H����373.4 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2CH3COOH(g)����ʵ���ò�ͬѹǿ�£���ϵ��ƽ��Ħ������
2CH3COOH(g)����ʵ���ò�ͬѹǿ�£���ϵ��ƽ��Ħ������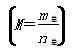 ���¶�(T)�ı仯������ͼ��ʾ������˵����ȷ����(����)
���¶�(T)�ı仯������ͼ��ʾ������˵����ȷ����(����)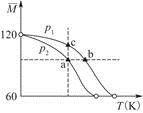
| A���ù��̵Ħ�H<0 |
| B������ѹǿ��p(a)<p(b)��p(c) |
| C��ƽ�ⳣ����K(a)��K(b)<K(c) |
| D���ⶨ�������Է�������Ҫ�ڸ�ѹ���������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com