
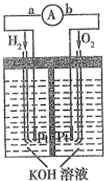
 氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉(金属铂吸附气体的能力强,性质稳定).请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉(金属铂吸附气体的能力强,性质稳定).请回答:分析 ①碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水;
②反应物接触面积越大,反应速率越快;
③根据化合价的变化判断氧化剂,根据氢气和转移电子之间的关系式计算.
解答 解:①碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O;
②反应物接触面积越大,反应速率越快,电极表面镀铂粉能增大反应物的接触面积,所以能增大反应速率,故答案为:增大电极单位面积吸附H2和O2的分子数,增大反应速率;
③a.LiH+H2O═LiOH+H2↑中水得电子作氧化剂,故答案为:H2O;
b.氢28g金属锂的物质的量为:$\frac{28g}{7g/mol}$=4mol,则生成4molLiH,4molLiH可生成4mol H2,实际参加反应的H2为4mol×80%=3.2mol,1molH2转化成1molH2O,转移2mol电子,所以3.2molH2可转移6.4mol的电子,故答案为:6.4mol.
点评 本题考查化学电源的工作原理及有关计算,题目难度较大,注意原电池电极反应式的书写以及从电子守恒的角度计算.


科目:高中化学 来源: 题型:选择题
| A. | 不能发生丁达尔效应的分散系有氯化钠溶液、水等 | |
| B. | 将1L 2mol•L-1的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| C. | 黄河入海口处三角洲的形成与胶体性质有关 | |
| D. | 将饱和FeCl3溶液加热至沸腾,制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | R | W |
| A. | 该五种元素一定为非金属元素 | |
| B. | 元素Y、Z、R的氧化物一定属于三种不同类型的晶体 | |
| C. | Z的原子序数可能是X的两倍 | |
| D. | W的最高价氧化物对应的水化物可能是最强的无机含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | C-C | O=O | C=O |
| 键能/kJ•mol-1 | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
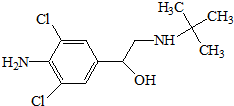 瘦肉精,学名盐酸克伦特罗,该药物既不是兽药,也不是饲料添加剂,而是肾上腺类神经兴奋剂,可以增加动物的瘦肉量.减少饲料使用.使肉品提早上市,降低成本,但对人体会产生副作用,盐酸克伦特罗分子结构简式如图.下列说法不正确的是( )
瘦肉精,学名盐酸克伦特罗,该药物既不是兽药,也不是饲料添加剂,而是肾上腺类神经兴奋剂,可以增加动物的瘦肉量.减少饲料使用.使肉品提早上市,降低成本,但对人体会产生副作用,盐酸克伦特罗分子结构简式如图.下列说法不正确的是( )| A. | 瘦肉精的分子式是C11H18ON2Cl2 | |
| B. | 物质能发生取代反应、氧化反应、加成反应和水解反应 | |
| C. | 1mol盐酸克伦特罗最多能与4molNaOH反应 | |
| D. | 盐酸克伦特罗分子中至少有7个碳原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性按X、Y、Z的顺序递增 | |
| B. | 三种元素的最高价氧化物对应的水化物酸性:H2ZO3>H3YO4>H2XO4 | |
| C. | 元素的最高正化合价按X、Y、Z的顺序递减 | |
| D. | 元素原子的半径按X、Y、Z的顺序递减 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com