
| A. | Cu | B. | C | C. | CuO | D. | CuCO3 |
分析 根据反应方程式中N元素化合价判断,硝酸中氮元素的化合价降低,则体现硝酸的氧化性,若生成硝酸盐,则体现硝酸的酸性.
解答 解:A.铜与稀硝酸反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,硝酸中部分氮元素的化合价由+5价降低为+4价,硝酸表现强氧化性,并且生成硝酸铜,则表现酸性,故A正确;
B.硝酸和碳反应的方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,该反应硝酸中的N元素化合价降低,所以硝酸只作氧化剂,则只体现氧化性,故B错误;
C.硝酸和氧化铜的反应方程式为:CuO+2HNO3=Cu(NO3)2+H2O,反应中没有元素化合价变化,不能体现硝酸的氧化性,硝酸全部生成硝酸盐,则只体现酸性,故C错误;
D.硝酸和碳酸铜反应生成硝酸铜、二氧化碳和水,只体现硝酸的酸性,故D错误;
故选A.
点评 本题考查了硝酸的性质,明确元素化合价是否变化是解本题关键,结合反应方程式来分析解答,难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | CO | B. | Fe2O3 | C. | CO2 | D. | Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 项目 | 实验目的 | 实验方案 |
| A | 验证稀硫酸和稀硝酸的氧化性强弱 | 将两块相同的铜片分别加入浓度均为2mol/L的硫酸和硝酸中,观察反应的难易程度 |
| B | 验证Cu、Fe的还原性强弱 | 将铁丝和铜丝分别插入浓硝酸中,观察反应的剧烈程度 |
| C | 验证Br、I非金属性强弱 | 将少量溴水加入KI-淀粉溶液中,观察溶液是否变蓝色 |
| D | 验证Mg、Al的金属性强弱 | 在Mg(OH)2、Al(OH)3中分别加入稀氨水,观察沉淀能否溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
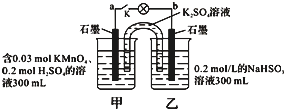 如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )| A. | 当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a | |
| C. | 电池工作时,甲烧杯发生的反应为MnO4-+3e-+4H+═MnO2+2H2O | |
| D. | 乙池中的氧化产物为SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{8}$mol 14CH4分子所含中子数为N0 | |
| B. | 7 g 14C原子形成的石墨完全燃烧生成二氧化碳时所转移的电子数为2N0 | |
| C. | 常温常压下,22.4 L含14C的二氧化碳中分子数等于N0 | |
| D. | 常温常压下,17 g甲基(-14CH3)所含电子数为9N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素周期律的实质是元素原子核外电子排步周期性变化的必然结果 | |
| C. | 半径由大到小、氧化性由弱到强的是K+、Mg2+、Al3+、H+,而还原性由弱到强的则是I-、Br-、Cl-、F- | |
| D. | 某元素R的最高价氧化物化学式为R2O5,又知R的气态氢化物中含氢的质量分数为8.8%,则R的相对原子质量为28 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | -2 | +2 | +1 | +5,-3 | +7,-1 | +1 | +5,-3 | +3 |
| A. | ⑧号元素为Al | |
| B. | 上述八种元素最高价氧化物对应的水化物⑤号酸性最强 | |
| C. | ②、③处于同一周期 | |
| D. | ④元素的气态氢化物沸点大干⑦元素的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)<c(Cu2+)<c(H+)<c(SO42-) | B. | c(OH-)<c(H+)<c(SO42-)<c(Cu2+) | ||
| C. | c(OH-)<c(H+)<c(SO42-)=c(Cu2+) | D. | c(OH-)<c(H+)<c(Cu2+)<c(SO42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com