
| ĪļÖŹ | X | Y | Z |
| ³õŹ¼ÅضČ/mol•L-1 | 0.1 | 0.2 | 0 |
| Ę½ŗāÅضČ/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A£® | ·“Ó¦“ļµ½Ę½ŗāŹ±£¬XµÄ×Ŗ»ÆĀŹĪŖ50% | |
| B£® | øıäĪĀ¶ČæÉŅŌøıä“Ė·“Ó¦µÄĘ½ŗā³£Źż | |
| C£® | Ōö“óŃ¹ĒæŹ¹Ę½ŗāĻņÉś³ÉZµÄ·½ĻņŅĘ¶Æ£¬Ę½ŗā³£ŹżŌö“ó | |
| D£® | ·“Ó¦æɱķŹ¾ĪŖX+3Y?2Z£¬ĘäĘ½ŗā³£ŹżĪŖ1600 |
·ÖĪö A£®XµÄ×Ŗ»ÆĀŹ=$\frac{XÅØ¶Č±ä»ÆĮæ}{XĘšŹ¼ÅضČ}$”Į100%£»
B£®Ę½ŗā³£ŹżÖ»ŹÜĪĀ¶ČÓ°Ļģ£¬ĪĀ¶Č±ä»Æ£¬Ę½ŗā³£ŹżŅ²·¢Éś±ä»Æ£»
C£®Ę½ŗā³£ŹżÖ»ŹÜĪĀ¶ČÓ°Ļģ£»
D£®X”¢YÅØ¶Č¼õŠ”£¬ĪŖ·“Ó¦Īļ£¬ZµÄÅضČŌö“ó£¬ĪŖÉś³ÉĪļ£¬ĒŅ×īÖÕX”¢YÅØ¶Č²»ĪŖ0£¬ĖµĆ÷ĪŖæÉÄę·“Ó¦£¬X”¢Y”¢Z»Æѧ¼ĘĮæŹżÖ®±ČĪŖ£Ø0.1-0.05£©mol/L£ŗ£Ø0.2-0.05£©mol/L£ŗ0.1mol/L=1£ŗ3£ŗ2£¬·“Ó¦æɱķŹ¾ĪŖX+3Y?2Z£¬Ę½ŗā³£ŹżK=$\frac{{c}^{2}£ØZ£©}{c£ØX£©”Į{c}^{3}£ØY£©}$£®
½ā“š ½ā£ŗA£®·“Ó¦“ļµ½Ę½ŗāŹ±£¬XµÄ×Ŗ»ÆĀŹĪŖ$\frac{£Ø0.1-0.05£©mol/L}{0.1mol/L}$=50%£¬¹ŹAÕżČ·£»
B£®Ę½ŗā³£ŹżÖ»ŹÜĪĀ¶ČµÄÓ°Ļģ£¬ĪĀ¶Čøı䏱£¬»ÆŃ§Ę½ŗā³£ŹżŅ»¶Ø±ä»Æ£¬¹ŹBÕżČ·£»
C£®Ę½ŗā³£ŹżÖ»ŹÜĪĀ¶ČµÄÓ°Ļģ£¬Ń¹ĒæøıäĘ½ŗā³£Źż²»±ä£¬¹ŹC“ķĪó£»
D£®X”¢YÅØ¶Č¼õŠ”£¬ĪŖ·“Ó¦Īļ£¬ZµÄÅضČŌö“ó£¬ĪŖÉś³ÉĪļ£¬ĒŅ×īÖÕX”¢YÅØ¶Č²»ĪŖ0£¬ĖµĆ÷ĪŖæÉÄę·“Ó¦£¬X”¢Y”¢Z»Æѧ¼ĘĮæŹżÖ®±ČĪŖ£Ø0.1-0.05£©mol/L£ŗ£Ø0.2-0.05£©mol/L£ŗ0.1mol/L=1£ŗ3£ŗ2£¬Ōņ·“Ó¦µÄ·½³ĢŹ½ĪŖX+3Y?2Z£¬Ę½ŗā³£ŹżK=$\frac{{c}^{2}£ØZ£©}{c£ØX£©”Į{c}^{3}£ØY£©}$=$\frac{0£®{1}^{2}}{0.05”Į0.0{5}^{3}}$=1600£¬¹ŹDÕżČ·£»
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗā¼ĘĖć”¢Ę½ŗā³£Źż¼ĘĖć¼°Ó°ĻģŅņĖŲ£¬ÄŃ¶Č²»“ó£¬×¢ŅāĘ½ŗā³£ŹżÖ»ŹÜĪĀ¶ČÓ°Ļģ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ¹ćĪ÷¹šĮÖŹ®°ĖÖŠøßČżÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
½šŹō(M)ØCæÕĘųµē³Ų(ČēĶ¼)¾ßÓŠŌĮĻŅ׵Ɣ¢ÄÜĮæĆܶČøßµČÓÅµć£¬ÓŠĶū³ÉĪŖŠĀÄÜŌ“Ęū³µŗĶŅʶÆÉč±øµÄµēŌ“”£øĆĄąµē³Ų·ÅµēµÄ×Ü·“Ó¦·½³ĢŹ½ĪŖ£ŗ4M+nO2+2nH2O=4M(OH) n”£ŅŃÖŖ£ŗµē³ŲµÄ”°ĄķĀŪ±ČÄÜĮæ”±Öøµ„Ī»ÖŹĮæµÄµē¼«²ÄĮĻĄķĀŪÉĻÄÜŹĶ·Å³öµÄ×ī“óµēÄÜ”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ( )
A£®²ÉÓƶąæ×µē¼«µÄÄæµÄŹĒĢįøßµē¼«Óėµē½āÖŹČÜŅŗµÄ½Ó“„Ć껿£¬²¢ÓŠĄūÓŚ ŃõĘųĄ©É¢ÖĮµē¼«±ķĆę
ŃõĘųĄ©É¢ÖĮµē¼«±ķĆę
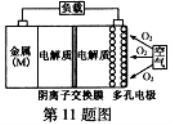 B£®±Č½ĻMg”¢Al”¢ZnČżÖÖ½šŹōØCæÕĘųµē³Ų£¬AlØCæÕĘųµē³ŲµÄĄķĀŪ±ČÄÜĮæ×īøß
B£®±Č½ĻMg”¢Al”¢ZnČżÖÖ½šŹōØCæÕĘųµē³Ų£¬AlØCæÕĘųµē³ŲµÄĄķĀŪ±ČÄÜĮæ×īøß
C£®MØCæÕĘųµē³Ų·Åµē¹ż³ĢµÄÕż¼«·“Ó¦Ź½£ŗ4Mn++nO2+2nH2O+4neØC=4M(OH)n
D£®ŌŚMØCæÕĘųµē³ŲÖŠ£¬ĪŖ·ĄÖ¹øŗ¼«Ēų³Į»żMg(OH)2£¬ŅĖ²ÉÓĆÖŠŠŌµē½āÖŹ¼°ŃōĄė×Ó½»»»Ä¤
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 50% | B£® | 60% | C£® | 80% | D£® | 90% |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Įņ“śĮņĖįÄĘ£ØNa2S2O3£©æÉÓĆ×ö·ÖĪöŹŌ¼Į¼°÷·øļ»¹Ō¼Į£®ĖüŹÜČČ”¢ÓöĖįŅ×·Ö½ā£®¹¤ŅµÉĻæÉÓĆ·“Ó¦£ŗ2Na2S+Na2CO3+4SO2ØT3Na2S2O3+CO2ÖĘµĆ£¬ŹµŃéŹŅÄ£ÄāøĆ¹¤Ņµ¹ż³ĢµÄ×°ÖĆČēĶ¼ĖłŹ¾£®£ØĖµĆ÷£ŗaÖŠŹ¢·ÅĻ”ĮņĖį£»bÖŠŹ¢·ÅNa2SO3¹ĢĢ壩»Ų“šĻĀĮŠĪŹĢā£ŗ
Įņ“śĮņĖįÄĘ£ØNa2S2O3£©æÉÓĆ×ö·ÖĪöŹŌ¼Į¼°÷·øļ»¹Ō¼Į£®ĖüŹÜČČ”¢ÓöĖįŅ×·Ö½ā£®¹¤ŅµÉĻæÉÓĆ·“Ó¦£ŗ2Na2S+Na2CO3+4SO2ØT3Na2S2O3+CO2ÖĘµĆ£¬ŹµŃéŹŅÄ£ÄāøĆ¹¤Ņµ¹ż³ĢµÄ×°ÖĆČēĶ¼ĖłŹ¾£®£ØĖµĆ÷£ŗaÖŠŹ¢·ÅĻ”ĮņĖį£»bÖŠŹ¢·ÅNa2SO3¹ĢĢ壩»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ĪĀ¶Č CO2×Ŗ»ÆĀŹ $\frac{n£Ø{H}_{2}£©}{n£ØC{O}_{2}£©}$ | 500K | 600K | 700K | 800K |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹żĮ涞Ńõ»ÆĆĢÓėÅØŃĪĖį¹²ČČ·“Ó¦ | |
| B£® | ¹żĮæµÄĒāĘųÓėÉŁĮæµŖĘųŌŚŅ»¶ØĢõ¼žĻĀ³ä·Ö·“Ó¦ | |
| C£® | ¹żĮæĶÓėÅØĮņĖį¹²ČČ·“Ó¦ | |
| D£® | ¹żĮæ°±Ė®ÓėĻõĖįŅųČÜŅŗ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C£ØCH3COOH£© | B£® | C£ØH+£© | C£® | C£ØH+£©/C£ØCH3COOH£© | D£® | C£ØCH3COOH£©/C£ØH+£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com