
【题目】实验室需纯净的NaCl晶体,但现有的NaCl晶体中混有少量的Na2SO4和NH4HCO3,为除去杂质,甲同学设计了如下实验:(已知NH4HCO3 ![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
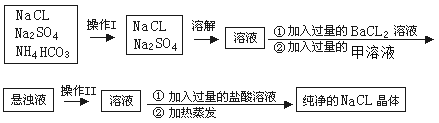
(1)上述操作I、II的名称分别为______、_______
(2)进行操作“加入过量的BaCl2溶液”时,如何判断BaCl2溶液已过量,其方法是______________________________________________________
(3)操作“加入过量的甲溶液”,甲溶液为______溶液,此操作的目的是________________________。
(4)操作“加入过量的盐酸溶液”的目的是________________________。
【答案】加热 过滤 取少量上层清液于试管中滴加氯化钡溶液,无沉淀出现,则说明氯化钡溶液过量 Na2CO3溶液 除去过量的钡离子 除去过量的碳酸钠
【解析】
NaCl晶体中混有少量的Na2SO4和NH4HCO3,加热固体,碳酸氢铵会分解生成氨气、二氧化碳和水蒸气,得到氯化钠和硫酸钠,溶于水得到溶液,加入过量氯化钡沉淀硫酸根离子,为了除去过量的钡离子,且在后续实验中容易除去引入的杂质,可加入过量碳酸钠溶液沉淀钡离子,过滤除去硫酸钡、碳酸钡沉淀,溶液中加入过量盐酸溶液除去碳酸钠,加热蒸发除去氯化氢得到氯化钠晶体,
(1)操作Ⅰ为加热分解碳酸氢铵,操作Ⅱ过滤除去硫酸钡和碳酸钡沉淀;
(2)进行操作“加入过量的BaCl2溶液”时,判断BaCl2溶液已过量,可以取反应后的上清液,检验是否还有硫酸根离子;
(3)为了除去过量的钡离子,且在后续实验中容易除去引入的杂质,可加入过量碳酸钠溶液沉淀钡离子;
(4)加入过量盐酸除去加入过量的碳酸钠。
NaCl晶体中混有少量的Na2SO4和NH4HCO3,加热固体,碳酸氢铵会分解生成氨气、二氧化碳和水蒸气,得到氯化钠和硫酸钠,溶于水得到溶液,加入过量氯化钡沉淀硫酸根离子,为了除去过量的钡离子,且在后续实验中容易除去引入的杂质,可加入过量碳酸钠溶液沉淀钡离子,过滤除去硫酸钡、碳酸钡沉淀,溶液中加入过量盐酸溶液除去碳酸钠,加热蒸发除去氯化氢得到氯化钠晶体,
(1)操作Ⅰ为加热分解碳酸氢铵,操作Ⅱ过滤除去硫酸钡和碳酸钡沉淀;
故答案为:加热;过滤;
(2)进行操作“加入过量的BaCl2溶液”时,判断BaCl2溶液已过量,可以取上层清液加入氯化钡观察是否有沉淀生成,从而判断氯化钡是否过量,若出现沉淀,证明未过量,若无沉淀,证明氯化钡过量;
故答案为:取少量上层清液于试管中滴加氯化钡溶液,无沉淀出现,则说明氯化钡溶液过量;
(3)为了除去过量的钡离子,且在后续实验中容易除去引入的杂质,可加入过量碳酸钠溶液沉淀钡离子;
故答案为:Na2CO3溶液;除去过量的钡离子;
(4)依据流程分析可知,加入过量盐酸除去加入过量的碳酸钠;
故答案为:除去过量的碳酸钠。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用加热法可除去Na2CO3中的NaHCO3
B. Na2CO3的热稳定性大于NaHCO3
C. 可用石灰水区分Na2CO3与NaHCO3溶液
D. Na2CO3和NaHCO3的水溶液均显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子的核外L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大,请回答下列问题:
(1)XZ2的分子式为__________,分子的立体构型为__________。
(2)YZ2的电子式为__________,其分子中含有__________条![]() 键,__________条π键。
键,__________条π键。
(3)Q的元素符号是__________,属于__________区,它的核外电子排布式为__________。价电子排布图为__________,在形成化合物时它最高的化合价为__________。
(4)E的单质与水反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以干海带为原料提取碘单质和氯化钾的过程主要分三步:完成下列填空:
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质。实验室灼烧海带应放在____(填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是____。
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液。实验室模拟氧化过程的实验装置如图所示。
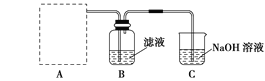
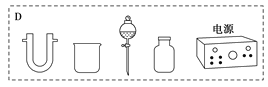
装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl-;二是电解法。限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是___(选填编号)。
a.2NaCl(s)+MnO2+2H2SO4(浓)![]() MnSO4+Cl2↑+Na2SO4+2H2O
MnSO4+Cl2↑+Na2SO4+2H2O
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
d.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
广口瓶B中发生反应的离子方程式是____。装置C中NaOH的作用是___。
(3)步骤三:取100 mL B中富碘溶液,按如下流程分离碘单质。
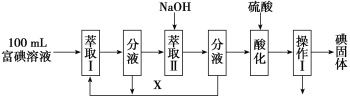
萃取Ⅱ和酸化过程发生的离子反应方程式分别是:
3I2+6OH-=5I-+IO3-+3H2O;____;
萃取剂X应选择____(选填编号)。
a.100mL苯 b.10mL乙醇 c.10 mLCCl4 d.10mL己烯
实验室进行萃取操作的仪器是_____。操作Ⅰ的名称是___。
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:①要用到的化学试剂是___(填写化学式);②要测定的物理量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,V L HCl溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系中不正确的( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84.回答下列问题:
(1)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。
① A的结构简式为___________________________名称为____________________________
② 链烃A与Br2的CCl4溶液反应生成B,写出由A生成B的化学方程式:______________
③ 与A互为同分异构体,且主链碳原子个数与A相同的链烃有_____种(不包括A)
(2)若A不能使溴水褪色,且分子中只有一种化学环境的氢原子,则A的结构简式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3溶液作为吸收液吸收SO2时,吸收液pH随n(SO32-)∶n(HSO3-)变化图像如图:
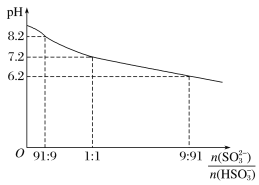
则以下离子浓度关系的判断正确的是
A. NaHSO3溶液中c(H+)<c(OH-)
B. Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C. 当吸收溶液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D. 当吸收溶液呈中性时,c(Na+)>c(HSO3-)+c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+2B(g) ![]() 2C(g) ΔH=-Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
2C(g) ΔH=-Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内气体密度逐渐减小
B. 平衡时,该反应放出的热量为Q kJ
C. 平衡后,再向容器中通入1 mol氦气,A的转化率增大
D. 平衡后,缩小容器容积,A的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是
A. 通常状况下,NA个Cl2分子的质量是71g
B. 通常状况下,NA个C02分子的体积约是22.4L
C. 0.1 mol/L的H2S04溶液中H+的个数是0.2NA
D. 若lg N2含有m个分子,则NA=m/28
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com