
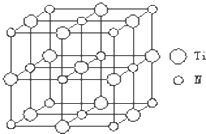
 在5-氨基四唑(
在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
| A、同温同压下,相同体积的物质,它们的物质的量必相等 |
| B、等体积、等物质的量浓度的强酸中所含的H+数目一定相等 |
| C、1 L一氧化碳气体的质量一定比1 L氧气的质量小 |
| D、任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 | B、2.0 |
| C、3.0 | D、4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
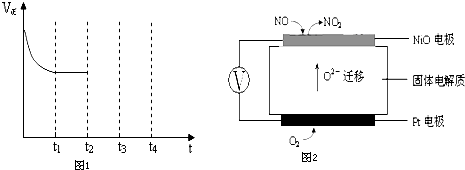
| 催化剂 |
投料比[
| 400K | 500K | 600K | ||
| 1 | 60% | 43% | 28% | ||
| 2 | 45% | 33% | 20% |
| n(NO2) |
| n(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
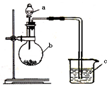 已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强.某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验.根据要求回答问题:
已知:元素最高价氧化物对应的水化物酸性越强,元素原子的得电子能力越强.某化学兴趣小组同学为了验证硫与碳的得电子能力的强弱,用如图所示装置设计实验.根据要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E为5种短周期元素,相对位置如图:
A、B、C、D、E为5种短周期元素,相对位置如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com