
下图所示为实验室中完成不同的化学实验所选用的装置或进行的操作,其中没有明显错误的是( )
| 测定中和热 | 用石灰石和稀盐酸制取CO2 | 蒸馏石油 | 配制溶液中转移溶液 |
|
|
|
|
|
| A | B | C | D |
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| ||
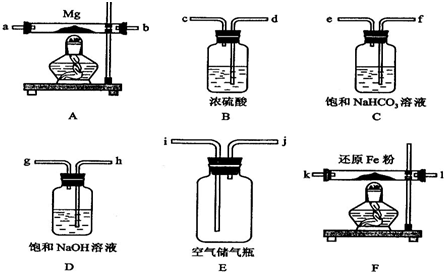
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
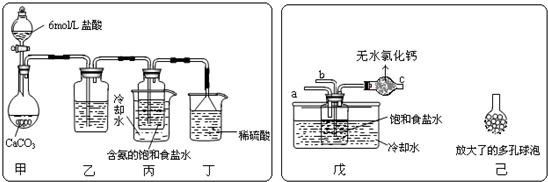
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
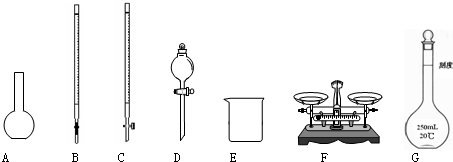
(W2-W1)g×
| ||||
| a g |
(W2-W1)g×
| ||||
| a g |
查看答案和解析>>
科目:高中化学 来源: 题型:
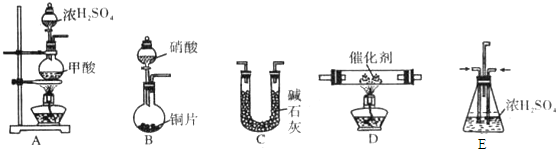
| 浓H2SO4 | △ |
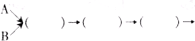 收集气体(填写装置编号)
收集气体(填写装置编号)查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省山大附中高二5月月考化学试卷(带解析) 题型:实验题
Ⅰ.(8分)某同学为了探究氯化铵的性质,进行了如下实验,请你按要求回答下列问题。
(1)配制100mL1mol/L的NH4Cl溶液。该同学应用托盘天平称量NH4Cl固体的质量为 g。
有以下仪器:烧杯、胶头滴管、玻璃棒等玻璃仪器。
①还缺少的仪器有 ;
②使用容量瓶前必须进行的一步操作是 ;
(2)该同学又用下图所示的装置做了有关氨气的性质实验。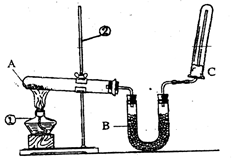
①写出实验室制氨气的化学方程式: ;
②写出B中盛放的是碱石灰其作用是 ;
③氨气极易溶于水,在氨水中滴加酚酞现象是 ;
④检验氨气的方法是 。
Ⅱ.(6分)在稀硝酸中放入足量的铜片:
(1)反应的化学方程式为 ;
(2)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是 。(用离子方程式表示)
(3)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6L(标
准状况下)。则所消耗的硝酸的物质的量是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com