
| A. | 95g | B. | 10g | C. | 50g | D. | 100g |
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
| N | O | F |
| P | S | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 | |
| C. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 实验室用排饱和食盐水法收集氯气 | |
| C. | 合成氨工业常采用Pt~Rh合金作为催化剂 | |
| D. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16:9 | B. | 23:9 | C. | 1:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO的含量保持不变 | |
| B. | 容器中CH3OCH3浓度与CO2浓度可能相同 | |
| C. | 3V正(CO)=V正(CH3OCH3) | |
| D. | 体系的温度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B的结构式为
,B的结构式为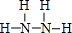 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H4、C3H4 | B. | C2H6、C3H6、C4H6 | C. | CH4、C2H6、C3H8 | D. | C2H4、C2H6、C3H4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com