
| A. | 向CaCl2溶液中通入过量SO2 | |
| B. | 向Na2SiO3溶液中滴入过量的盐酸 | |
| C. | 向饱和的Na2CO3溶液中通入过量CO2 | |
| D. | 向Al2(SO4)3溶液中滴入过量的NaOH溶液 |
分析 A.氯化钙与二氧化碳不能反应;
B.硅酸不能溶于盐酸;
C.碳酸钠的溶解度大于碳酸氢钠,据此判断;
D.偏铝酸钠和盐酸反应生成氢氧化铝沉淀,氢氧化铝和盐酸反应生成氯化铝.
解答 解:A.氯化钙与二氧化碳不能反应生成碳酸钙,故A错误;
B.硅酸钠与盐酸反应生成硅酸,硅酸是难溶于水和盐酸的酸,不会出现沉淀溶解的现象,故B错误;
C.向饱和碳酸钠溶液中通入过量的CO2,碳酸钠和二氧化碳、水反应生成碳酸氢钠,反应为Na2CO3+CO2+H2O=2NaHCO3,碳酸氢钠的溶解性小于碳酸钠的溶解性,原碳酸钠溶液是饱和溶液,生成碳酸氢钠后溶液变成过饱和溶液,所以会析出部分碳酸氢钠晶体,所以不出现“先产生沉淀,然后沉淀又溶解”现象,故C错误;
D.两者混合,化学反应方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,所以发生“先沉淀后溶解”现象,故D正确,故选D.
点评 本题考查较为综合,涉及元素化合物知识,胶体等,解答本题的关键是把握物质的性质,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:填空题
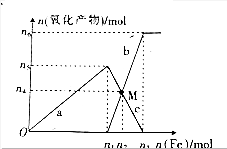 与加入铁粉的物质的量的关系如图所示.
与加入铁粉的物质的量的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
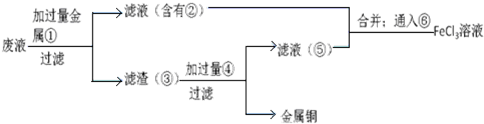
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaHCO3固体加入新制氯水,有无色气泡(H+) | |
| B. | 滴加AgNO3溶液生成白色沉淀(Cl-) | |
| C. | 向KI溶液中滴加氯水,再滴加CCl4溶液,发现CCl4溶液呈紫色(Cl2) | |
| D. | 使红色布条褪色(HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液溶胶都是澄清透明的 | |
| B. | 胶体粒子的直径在1nm~100nm | |
| C. | 可用渗析法(半透膜过滤法)分离液溶胶中的分散质与分散剂 | |
| D. | 可以利用丁达尔效应区分胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10 mL量筒量取7.13 mL盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用托盘天平称量25.20 g NaCl | |
| D. | 用25ml碱式滴定管量取21.70 mLNaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com