
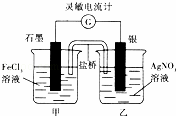
控制适合的条件,将反应Fe3++Ag⇌Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂﹣硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度).已知接通后观察到电流计指针向右偏转.下列判断正确的是( )
|
| A. | 盐桥中的K+移向乙烧杯 |
|
| B. | 一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 |
|
| C. | 在外电路中,电子从石墨电极流向银电极 |
|
| D. | 电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 |
| 原电池和电解池的工作原理. | |
| 分析: | A.该原电池中,Ag失电子作负极,石墨作正极,盐桥中阳离子移向正极; B.一段时间后,原电池反应结束; C.原电池外电路电子由负极流向正极; D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,铁活泼性强于银,形成新的原电池,铁做负极,银做正极. |
| 解答: | 解:A.该原电池中,Ag失电子作负极,石墨作正极,盐桥中K+是阳离子移向正极,故A错误; B.一段时间后,原电池反应结束,流计指针指向0,故B错误; C.原电池外电路电子由负极流向正极,所以电子从银电极流向石墨电极,故C错误; D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,铁活泼性强于银,形成新的原电池,铁做负极,银做正极,电流计指针向左偏转,故D正确; 故选:D. |
| 点评: | 本题是对原电池原理综合考查,明确原电池工作原理、准确判断原电池中正负电极是解题关键,题目难度中等. |


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
假设19.2g Cu与足量的稀硝酸完全反应,试回答:
(1)写出铜与稀硝酸反应的化学方程式
(2)反应后生成硝酸铜的物质的量
(3)参加反应的稀硝酸的物质的量
(4)标准状况下,生成NO气体的体积
(5)被还原硝酸的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4 L NO与11.2 L O2充分反应后得到的气体分子数为NA
B.3.6 g重水中含有的中子数为2NA
C.一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA
D.常温下,1 L 1 mol·L-1的CH3COOH溶液中,所含溶质分子数小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的化学方程式或离子方程式不正确的是( )
|
| A. | 向饱和Na2CO3中加入过量CO2气体:CO32﹣+CO2+H2O=2HCO3﹣ |
|
| B. | 在沸水中滴入饱和FeCl3溶液制取Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3(胶体)+3H+ |
|
| C. | 4mol/L的NaAlO2溶液和7mol/L的盐酸等体积混合:4AlO2﹣+7H++H2O=3Al(OH)3↓+Al3+ |
|
| D. | 酸化的KMnO4溶液与H2O2反应:2MnO4﹣+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法正确的是( )
|
| A. | 1molCl2参加的任何反应转移电子数都是2NA |
|
| B. | 1mol/L的NaCl溶液中含有NA个Na+ |
|
| C. | 标准状况下,22.4ml水中含有的分子数约为1.24NA |
|
| D. | 1molFeCl3完全水解生成NA个胶体粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g)⇌xC(g)+D(s),向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C和2mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,下列叙述中正确的是( )
|
| A. | 若平衡时,甲、乙两容器中A的物质的量不相等,则x=4 |
|
| B. | 平衡时,甲、乙两容器中A、B的物质的量之比不相等 |
|
| C. | 平衡时甲中A的体积分数为40% |
|
| D. | 若平衡时两容器中的压强不相等,则两容器中压强之比为8:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);△H<0(kJ•mol﹣1)的化学反应,下列叙述一定正确的是( )
|
| A. |
反应过程中能量关系可用右图表示 |
|
| B. | 1mol锌的能量高于1molH2所含的能量 |
|
| C. | 若将该反应设计成原电池,则锌为正极 |
|
| D. | 若将其设计为原电池,则当有32.5g锌溶解时,正极放出的气体体积一定为22.4L(标况) |
查看答案和解析>>
科目:高中化学 来源: 题型:
为比较Fe3+和Cu2+对H2O2分解的催化效果强弱,甲乙两组同学分别设计了如图一、图二所示的实验.
(1)图一可通过观察 (现象)定性比较得出结论.有同学提出将CuSO4改为CuCl2或将FeCl3改为浓度相当的Fe2(SO4)3更为合理,其理由是: .
(2)图二所示实验中需测量的数据是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.如图可表示水分解过程中的能量变化
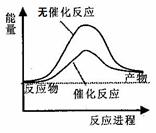
B.任何能使熵值减小的过程都能自发进行
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g) △H=- a kJ/mol,
Ⅱ:
且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com