
某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
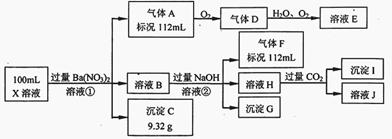
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
若要用实验证明该阴离子是否存在,最可靠的化学方法是_____________。
(2)尽量用离子方程表达下列反应:
①中生成气体A:_____________。
②中生成溶液H:_____________。
③中产生的气体F遇氯气产生白烟:_____________。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为___________mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
【知识点】离子反应 离子方程式的书写 电荷守恒用于计算B1 B3
【答案解析】(1) Fe3+ 、Cl-(2分) 取少量B溶液于试管中,向其中滴加AgNO3溶液,若有白色沉淀生成,说明存在Cl—,否则Cl—不存在。(其它合理答案也可)。(2分)
(2) 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O (2分)
Al3+ +4OH—=AlO2—+2H2O(2分)
8NH3+3Cl2=6 NH4Cl+N2(2分)
(3) 0.15 0.1 0.4 (各1分)
解析:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子。根据离子间的反应溶液中含有Fe2+离子就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是Fe3+和Cl-,
若要用实验证明该阴离子是否存在,最可靠的化学方法是:取少量B溶液于试管中,向其中滴加AgNO3溶液,若有白色沉淀生成,说明存在Cl—,否则Cl—不存在。
(2)
①中生成气体A:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
②中生成溶液H:Al3+ +4OH—=AlO2—+2H2O
③中产生的气体F遇氯气产生白烟:8NH3+3Cl2=6 NH4Cl+N2
(3)根据3Fe2++4H++NO3-=3Fe3++NO+2H2O,利用NO的体积是112mL得Fe2+的物质的量为3×(112mL/22400mL)=0.015mol, c(Fe2+)=0.15mol/L;消耗的氢离子的物质的量为4×(112mL/22400mL)=0.02mol;过量的氢离子的物质的量为2mol/L×0.01L=0.02mol,
原100mLx溶液中c(H+)=(0.02+0.02)mol/0.1L=0.4mol/L
F为NH3,所以c(NH4+)=(112mL/22400mL)/0.1L=0.05mol/L;
溶液中C(Al3+)=(0.03-0.025)mol/0.1L=0.05mol/L;
溶液中c(Fe3+)=0.025mol/0.1L-0.15mol/L=0.1mol/L;
溶液中c(SO42-)=(9.32g/233g/mol)/0.1L=0.4mol;
利用电荷守恒得:0.4×1+0.15×2+0.05×1+0.05×3+0.1×3 =0.4×2+c(Cl-)×1;解得c(Cl-)=0.4mol/L
则原溶液中c(Fe2+)为0.15mol/L、c(Fe3+)为0.1mol/L、c(Cl-)为0.4mol/L。
【思路点拨】本题以框图推断的形式考查了离子反应、离子方程式的书写、利用溶液中电荷守恒进行计算,(3)的计算繁琐,溶液因丢落离子而导致错误出现,分析需严谨。


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有________(填字母)。
a.减少化石燃料的使用
b.植树造林,增大植被面积
c.采用节能技术
d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O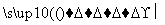 C6H12O6+6O2
C6H12O6+6O2
b.CO2+3H2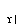 CH3OH+H2O
CH3OH+H2O
c.CO2+CH4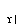 CH3COOH
CH3COOH
d.2CO2+6H2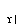 CH2===CH2+4H2O
CH2===CH2+4H2O
以上反应中,最节能的是____________,原子利用率最高的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
MgSO4·7H2O在医药上常用作泻药,工业上可用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。其主要工艺如下:
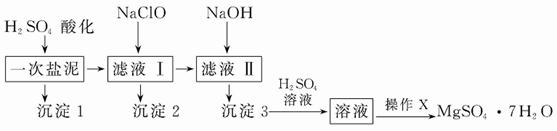
请回答下列问题:
(1)用H2SO4调节溶液pH至1~2,H2SO4的作用是______________________。
(2)加NaClO溶液至pH为5~6并加热煮沸5分钟~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为__________________、________________;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为____
_____________________________________________________。
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是________________________。
(4)“操作X”是将溶液____________________、____________________、过滤洗涤,即得到MgSO4·7H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如图:
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式 :
(2)加6%的H2O2时,温度不能过高,其目的是
(3)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀.在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为
(4)上述流程中滤液Ⅲ的主要成分是
(5)操作Ⅰ包括以下过程:过滤,溶解, , ,洗涤获得NiSO4•6H2O晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH 、Cl-、S2-
、Cl-、S2-
B.0.1 mol·L-1FeCl3溶液中大量存在Fe2+、NH 、SCN-、SO
、SCN-、SO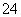
C.0.1 mol·L-1NH4HCO3溶液中:K+、Na+、NO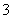 、Cl-
、Cl-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO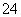
查看答案和解析>>
科目:高中化学 来源: 题型:
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断
正确的是( )
A.在含等物质的量的AlO2-、OH-、CO32--的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B.在含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C.在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2: KOH、Ba(OH)2、K2CO3、BaCO3
D.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种易溶于水的物质,分别由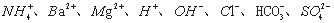 中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中
中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中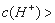 0.1mol/L;③向丙溶液中滴入
0.1mol/L;③向丙溶液中滴入 溶液有不溶于稀
溶液有不溶于稀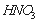 的白色沉淀生成,下列结论不正确的是 ( )
的白色沉淀生成,下列结论不正确的是 ( )
A .甲溶液含有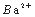 B. 乙溶液含有
B. 乙溶液含有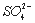 C .丙溶液含有
C .丙溶液含有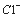 D.丁溶液含有
D.丁溶液含有
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式与所述事实相符且正确的是( )
A.在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:
Mn2++ClO-+H2O===MnO2↓+Cl-+2H+
B.用稀硝酸清洗做过银镜反应的试管:Ag+NO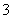 +4H+===Ag++NO↑+2H2O
+4H+===Ag++NO↑+2H2O
C.向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
D.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:
2Cl-+2H2O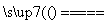 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com