
【题目】以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:
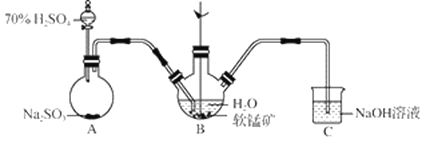
步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
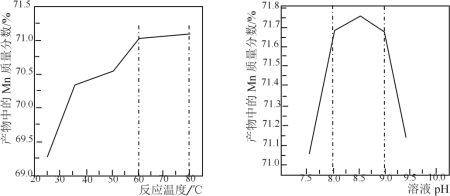
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。
【答案】Na2SO3 + H2SO4 = Na2SO4+SO2↑+H2O 用90~100℃的水浴加热 吸收未反应的SO2 将Fe2+氧化为Fe3+ 4.9<pH<7.56 将滤液加热并保温在60~80℃,用氨水调节溶液pH并维持8~9,在不断搅拌下,边通空气边滴加氨水,至有大量黑色沉淀时,静置,在上层清液再滴加氨水至无沉淀,过滤,用去离子水洗涤沉淀直至过滤液中检不出SO42-
【解析】
(1)装置A制取SO2,发生的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)温度维持在90~100℃,适宜的加热方式为90~100℃的水浴加热;
(3)SO2有毒,污染空气,因此装置C的作用是吸收未反应的SO2;
(4)根据软锰矿中含有成分,以及表格中数据,MnO2作氧化剂,将Fe2+氧化成Fe3+,便于除去;加入MnCO3调节溶液的pH,使Fe3+、Al3+以氢氧化物的形式沉淀出来,但Mn2+不能沉淀出来,即调节的pH的范围是4.9≤pH<7.56;
(5)根据信息温度超过80℃,Mn3O4的产率开始降低,根据信息③,Mn3O4中Mn质量分数理论值为72.03℃,因此温度控制在60℃~80℃之间,根据pH与产物中Mn质量分数之间的关系,pH应控制在8~9之间,因此具体操作是将滤液加热并保温在60~80℃,用氨水调节溶液pH并维持8~9,在不断搅拌下,边通空气边滴加氨水,至有大量黑色沉淀时,静置,在上层清液再滴加氨水至无沉淀,过滤,用去离子水洗涤沉淀直至过滤液中检不出SO42-;


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】在不同温度下(T1 <T2),可逆反应2X(g) ![]() 2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(
2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(![]() )与反应时间(t)的关系有以下图示,正确的是
)与反应时间(t)的关系有以下图示,正确的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积为2 L的密闭容器内(预先加入催化剂)通入2 mol NH3,经过一段时间达平衡后,测得容器内的压强为起始时的1.2倍。则NH3的转化率为
A. 25% B. 80% C. 10% D. 20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与浓硫酸在加热条件下发生反应。
(1)请同学们写出该反应方程式_______________________________________;
(2)其中______为还原剂,浓硫酸表现的性质__________(酸性、强氧化性、强氧化性和酸性);
(3)当3molCu参加反应,转移的电子数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca(NO2)2(亚硝酸钙)是易溶于水的无色晶体,可用作混凝土中钢筋的防护剂。
(1)Ca(NO2)2的制备方法很多。
①实验室可用反应Ca(NO3)2+2CaFe2O4+4NO![]() 3Ca(NO2)2+2Fe2O3制备Ca(NO2)2,该反应中被氧化的N原子与被还原的N原子的物质的量之比为_____。
3Ca(NO2)2+2Fe2O3制备Ca(NO2)2,该反应中被氧化的N原子与被还原的N原子的物质的量之比为_____。
②用石灰乳吸收硝酸工业尾气中氮氧化物制备Ca(NO2)2,其中NO2与Ca(OH)2反应生成Ca(NO2)2和Ca(NO3)2的化学方程式为_____,经过滤得到含Ca(NO2)2的溶液为液态产品。
(2)测定某液态产品中NO3-含量的步骤如下:
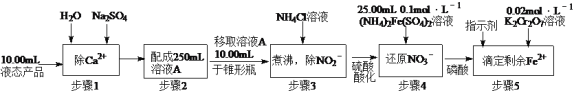
已知:步骤4中的反应为NO3—+3Fe2++4H+=3Fe3++NO↑+2H2O,
步骤5中的反应为6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O。
若步骤5滴定至终点时消耗K2Cr2O7溶液20.00mL,计算液态产品中NO3-的含量(单位g·L-1,最后结果保留一位小数,写出计算过程)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列表格。
物质 | 分子数 | 质量 | 物质的量 | 摩尔质量 |
氮气 | _____ | 14 g | _____ | _____ |
硫酸 | 3.01×1022 | _____ | _____ | _____ |
水 | _____ | _____ | 0.5 mol | 18 g·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物与我们的生活息息相关。下列说法正确的是
A. 卤代烃C3H7Cl有三种同分异构体
B. 石油裂解的目的是为了提高轻质液体燃料的产量和质量
C. 棉花和合成纤维的主要成分都是纤维素
D. 结构简式如图所示的有机物能发生加成反应、取代反应、氧化反应

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s) ![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B. CaCO3(s)加热分解生成CaO(s)和CO2(g),△S<0
C. 将容器体积增大为原来的2倍,平衡向正反应方向移动
D. 保持容器体积不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应: 2SO2(g)+O2(g)![]() 2SO3(g);△H<0,
2SO3(g);△H<0,
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是

Ⅰ II III
A. 图I研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图II研究的是t0时刻加入催化剂后对反应速率的影响
C. 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com