
| A. | 二氧化碳的分子式: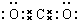 | |
| B. | Cl-的结构示意图: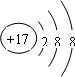 | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | 质子数为53、中子数为78 的碘原子:${\;}_{53}^{131}$I |
分析 A、分子式是表示物质元素组成的式子;
B、氯离子的最外层有8个电子;
C、烯烃的结构简式中碳碳双键不能省略;
D、质子数+中子数=质量数.
解答 解:A、分子式是表示物质元素组成的式子,故二氧化碳的分子式为CO2,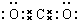 为二氧化碳的电子式,故A错误;
为二氧化碳的电子式,故A错误;
B、氯离子是由氯原子得一个电子得到的,故核内有17个质子,带17个正电荷,核外的最外层有8个电子,故结构示意图为 ,故B正确;
,故B正确;
C、烯烃的结构简式中碳碳双键不能省略,即乙烯的结构简式应为CH2=CH2,故C错误;
D、在表示原子时,将质子数写在左下角,质量数写在左上角,而质子数+中子数=质量数,故质子数为53、中子数为78的碘原子的质量数为131,即表示为${\;}_{53}^{131}$I,故D正确.
故选BD.
点评 本题考查了原子、离子和分子的表示方法,应注意的是在书写烯烃或炔烃的结构简式时,碳碳双键和碳碳双键均不能省略.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷与四氯化碳分子都是含有极性键的极性分子 | |
| B. | 甲烷与四氯化碳分子内的键角均为60° | |
| C. | 甲烷分子比四氯化碳稳定,因为C-H键键能比C-Cl键大 | |
| D. | 甲烷沸点低于四氯化碳,因为C-H键键长比C-Cl键短 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者均为弱酸 | |
| B. | 两者均可使紫色石蕊试液变红色 | |
| C. | CO2气体通入Na2SiO3溶液中可以制得硅酸 | |
| D. | 两者受热时均可以分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑦ | B. | ①②④⑤ | C. | ②③④⑤ | D. | ①②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com