
| A. | Al(OH)3→Al2O3 | B. | Al2O3→Al(OH)3 | C. | Al→Al(OH)3 | D. | SiO2→H2SiO3 |
分析 A、Al(OH)3加热分解生成Al2O3;
B、氧化铝溶于碱生成偏铝酸盐,溶于酸生成铝盐,不能生成氢氧化铝;
C、铝溶于碱生成偏铝酸盐,溶于酸生成铝盐,不能生成氢氧化铝;
D、二氧化硅不能溶于水,只能先溶于碱生成硅酸盐,然后与酸反应生成硅酸.
解答 解:A、Al(OH)3加热分解生成Al2O3,能通过一步完成,故A正确;
B、氧化铝溶于碱生成偏铝酸盐,偏铝酸盐与弱酸反应生成氢氧化铝,不是一步完成,故B错误;
C、铝溶于碱生成偏铝酸盐,偏铝酸盐与弱酸反应生成氢氧化铝,不是一步完成,故C错误;
D、二氧化硅不能溶于水,二氧化硅溶于氢氧化钠生成硅酸钠,硅酸钠与碳酸反应生成硅酸,不是一步完成,故D错误,故选A.
点评 本题考查元素化合物物质之间的转化等,比较基础,掌握物质的性质是解答本题的关键,注意基础知识的积累掌握.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | 只有⑤ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X、Y、Z三种元素中,X的非金属性最强 | |
| B. | Y的氢化物的稳定性比Z的氢化物弱 | |
| C. | Y的最高正化合价为+7 | |
| D. | X的单质的熔点比Z的低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
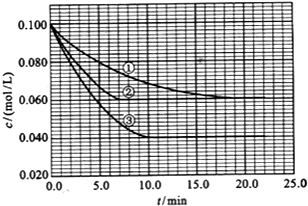 在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:
在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯中含有3nA个碳碳双键 | |
| B. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 一定条件下2 mol SO2和1 mol O2充分反应后,混合气体的分子总数大于2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com