
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用双氧水滴定KI-淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
B | 向食用加碘盐中加入食醋和KI溶液,再加入CCl4振荡,静置 | 下层呈紫红色 | 该食用加碘盐中含有KIO3 |
C | 用湿润的淀粉碘化钾试纸鉴别NO2、溴蒸气 | 试纸变蓝 | 该气体为溴蒸气 |
D |
| 最后试管有浅黄色沉淀 | 有机物中含有溴原子 |
A. AB. BC. CD. D
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是( )
H+ + O22-)下列分析不正确的是( )

A.①、⑤中产生的气体能使带火星的木条复燃
B.①、④中均发生了氧化还原反应和复分解反应
C.②、⑤中KMnO4与MnO2的作用不同
D.通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构是:关于它的性质的描述正确的是( )
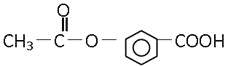
①能发生加成反应; ②能溶解于NaOH溶液中; ③能水解生成两种有机物;
④不能使溴水褪色; ⑤能发生酯化反应; ⑥有酸性
A. ①②③B. ②③⑤C. 仅⑥D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍、工业上用ClO2气体制 NaClO2的工艺流程如下:
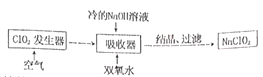
已知: NaClO2的溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2。下列说法不正确的是( )
A.流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤
B.提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
C.吸收器中生成的NaClO2的离子方程式:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O
D.发生器中反应结束后,向其中通入空气的目的是驱赶出ClO2,使其被充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),实验测得的不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g),实验测得的不同温度下的平衡数据列于下表:
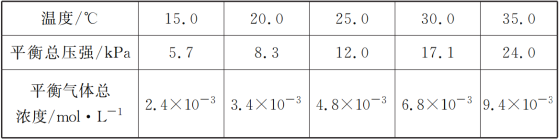
①可以判断该分解反应已经达到平衡的是___________
A. 2v(NH3)=v(CO2)
B. 密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0 ℃时氨基甲酸铵的分解平衡常数表达式为________;平衡常数为________;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_______ (填“增加”“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH________0(填“>”“=”或“<”),熵变ΔS______0(填“>”“=”或“<”)。
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。
NH4HCO3+NH3·H2O。
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示。
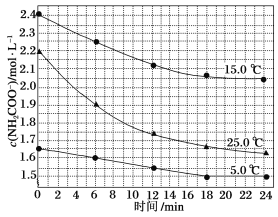
⑤计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:_______
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25.0 ℃时反应物的起始浓度较小,但0~6 min的平均反应速率(曲线的斜率)仍比15.0 ℃时的________(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计城市机动车辆每年以15%至20%的速度增长,交通事故也频发,汽车在剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。则下列判断正确的是
A. 还原剂与氧化产物的物质的量之比为5:8
B. 若氧化产物比还原产物多1.4mol则转移电子为1mol
C. 每生成1.6mol氮气,则有0.2molKNO3被氧化
D. NaN3是只含有离子键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用KClO3和50mL浓盐酸反应制取Cl2,反应原理如下:
KClO3+HCl→KCl+Cl2↑+H2O
(1)配平上述化学方程式并用双线桥标出电子转移方向与数目__________________;
(2)浓盐酸在上述反应中表现出来的性质是__(填选项编号)
A.只有氧化性 B.只有还原性 C.还原性和酸性 D.氧化性和酸性
(3)若产生0.1mol Cl2,则转移电子的物质的量为_______(保留两位小数)
(4)若反应中HCl的利用率只有50%,当氧化产物比还原产物比还原产物多7.1g时,浓盐酸的物质的量浓度为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图:
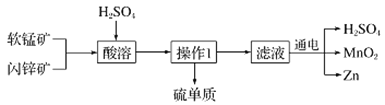
下列说法不正确的是( )
A.干电池是一种将化学能转变为电能的装置
B.酸溶时,ZnS作还原剂,每析出12.8gS沉淀,共转移0.8mol电子
C.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O═MnO2+4H+
D.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式为![]() ,判断下列说法中不正确的是
,判断下列说法中不正确的是
A. 它可以使酸性KMnO4溶液褪色
B. 它可发生取代反应、加成反应、加聚反应、氧化反应
C. 它与氢气发生加成反应,最多可以消耗5mol氢气
D. 1mol该有机物燃烧消耗氧气为18.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com