
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。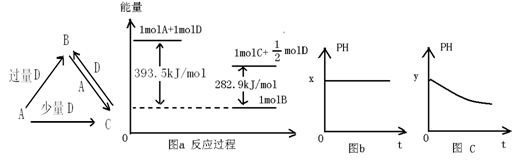
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 ;
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为 ;
②反应B+A→C的离子方程式为 ;
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D的化学式为 ;
②若图c符合事实,则其pH变化的原因是 (用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式: 。
(1)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(2)①Al(OH)3②Al3++3AlO2-+6H2O=4Al(OH)3↓
(3)①CO2②2HSO3-+O2=2H++2SO42-
(4)C(s)+1/2O2(g)="CO(g)" ⊿H=-110.6kJ/mol
解析试题分析:(1)A为金属单质,随D酸的稀溶液的量的不同而产物不同,故A是变价金属,故是Fe,D酸具有氧化性,稀溶液具有氧化性的酸是HNO3,故C+D→B反应为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;(2)A、B为盐,A随强碱D溶液的量的不同而产物不同,A的水溶液显酸性,则是Al3+,C为Al(OH)3,B+A→C为Al3++3AlO2-+6H2O=4Al(OH)3↓;(3)A为强碱,D为气态氧化物,D为二元酸酸酐,可以是CO2或SO2,b图是pH不变,为CO2;pH减小的是SO2,因为亚硫酸在空气中易氧化为硫酸使pH减小,即2HSO3-+O2=2H++2SO42-;(4)A为非金属单质,空气主要成分D易反应是O2,能量关系看出反应计量:A+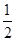 O2→C,C+
O2→C,C+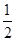 O2→B,A元素有+2、+4价,故A是碳,A+D→C的热化学方程式是C(s)+
O2→B,A元素有+2、+4价,故A是碳,A+D→C的热化学方程式是C(s)+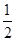 O2(g)="CO(g)" ⊿H=-110.6kJ/mol。
O2(g)="CO(g)" ⊿H=-110.6kJ/mol。
考点:元素单质及其化合物之间的转化。


科目:高中化学 来源: 题型:单选题
下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 将少量某无色气体通入澄清石灰水 | 出现白色沉淀 | 该气体一定是CO2 |
| C | 分别用测定常温下0.1 mol·L--1 Na2SiO3和Na2CO3的PH | PH:Na2SiO3﹥Na2CO3 | 非金属性Si﹥C |
| D | 向浓度均为0.1 mol·L-1NaCl和NaI混合溶液中, 滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.硅是一种重要的非金属单质,可用于制造太阳能电池 |
| B.硫在足量的空气中燃烧生成SO3 |
| C.钠在空气中燃烧生成氧化钠 |
| D.与同浓度稀盐酸反应的速率:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关物质的性质和该性质的应用均正确的是
| A.H2O2是一种绿色氧化剂,可与酸性高锰酸钾作用产生 |
| B.SiO2晶体硅具有半导体性质,可用于生产光导纤维 |
| C.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D.铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)。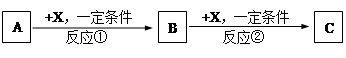
试回答:
(1)若X是强氧化性单质,则A不可能是 。
a. S b. N2 c. Na d. Mg e. Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属元素价态的操作方法是: 。则B的化学式为 。
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,B为两性化合物,则X的化学式可能为(写出不同类物质) 或 ,
反应①的离子方程式为(写一条) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢气是一种清洁能源,氢气的制取与储存是氢气能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH =+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH =+247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g)ΔH =+169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与 H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为_________________________
(2)H2S 热分解制氢时,常向反应器中通入一定比例空气,使部分 H2S 燃烧,其目的是________;燃烧生成的 SO2与 H2S 进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:___________________________
(3)H2O 的热分解也可得到 H2,高温下水分解体系中主要气体的体积分数与温度的关系如图甲所示。图中 A、B 表示的物质依次是______________________________________。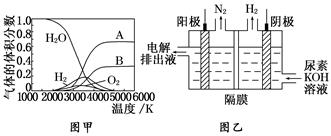
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图乙(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_____________________
(5)Mg2Cu 是一种储氢合金。 350 ℃时,Mg2Cu 与 H2反应,生成 MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为 0.077)。Mg2Cu 与 H2反应的化学方程式为_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下图所示: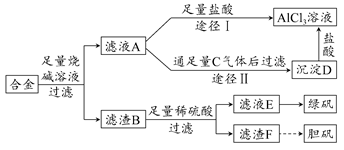
试回答下列问题:
(1)过滤时用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是________。
(2)由滤液A制AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是________,理由是_____________________________。
(3)从滤液E中得到绿矾晶体的实验操作是________。
(4)写出用滤渣F制备胆矾晶体的化学方程式_______________________。
(5)有同学提出可将方案中最初用于溶解合金的烧碱改为盐酸,重新设计方案,也能制得这三种物质,你认为后者的方案是否合理?________,理由是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。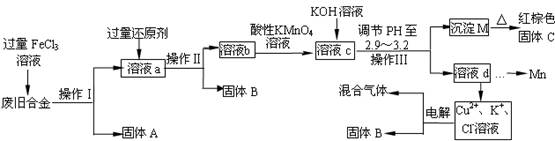
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式: 。
(3)过量的还原剂应是 ,溶液b中所含的金属阳离子有 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为 。
②若用Xmol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: > > 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Zg,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期的常见元素,其相关信息如下表:
| X | X的一种核素的质子数为56,中子数为30 |
| Y | 海水中元素含量最高的金属元素 |
| Z | 常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
| W | 价电子的排布式为3s23p3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com