
 目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.
目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.分析 (1)根据盖斯定律计算焓变书写热化学方程式,a、N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
b、4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ/mol
c、2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
则反应N2(g)+3H2(g)?2NH3(g)可以是:a+$\frac{3}{2}$×b-$\frac{1}{2}$×c得到;
(2)根据三行式计算反应速率和转化率,v=$\frac{△c}{△t}$,转化率=$\frac{消耗量}{起始量}$×100%;
(3)根据影响化学平衡移动的因素以及影响K的因素来回答即可,平衡常数只受温度的影响;
解答 解:(1)已知:a、N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
b、4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ/mol
c、2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
则反应N2(g)+3H2(g)?2NH3(g)可以是:a+$\frac{3}{2}$×b-$\frac{1}{2}$×c得到,所以△H=180.5kJ/mol+$\frac{3}{2}$×(-905kJ/mol)-$\frac{1}{2}$×(-483.6kJ/mol)=-92.4kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol;
②在2L密闭容器中投入1molN2和3molH2,平衡时,容器中氨气的体积分数是25%,设氮气的变化量是x,则
N2+3H2?2NH3,
起始量(mol) 0.5 1.5 0
变化量(mol) x 3x 2x
平衡量(mol)0.5-x 1.5-3x 2x
容器中氨气的体积分数是25%,得到$\frac{2x}{0.5-x+1.5-3x+2x}$×100%=25%,解得x=0.2mol/L,
N2的转化率=$\frac{0.2}{0.5}$×100%=40%;则0~10min,NH3的平均速率为$\frac{0.4mol/L}{10min}$=0.04mol/(L•min).
故答案为:0.04mol/(L•min);40%;
③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH3,压强减小,平衡逆向移动,再达平衡时,N2的体积分数将增大,平衡常数只受温度的影响,温度不变,K不变,
故答案为:增大;不变.
点评 本题涉及热化学中盖斯定律的应用以及化学反应速率、平衡的计算等知识,属于综合知识的考查,难度不大.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →CH≡C-CH═CH2
→CH≡C-CH═CH2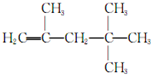 ,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是
,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是 ,丙的结构简式是
,丙的结构简式是 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g Fe与足量稀HNO3发生反应,转移的电子数为0.3 NA | |
| B. | 在1 L 0.1 mol/L AlCl3溶液中含有0.1 NA 个Al3+ | |
| C. | 在某密闭容器中盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应后,可得0.2NA个NH3分子 | |
| D. | 标准状况下,11.2 L四氯化碳中含有的C-Cl键的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  振荡后静置,溶液不再分层,且保持无色透明 | |
| B. |  铁片最终完全溶解,且高锰酸钾溶液变无色 | |
| C. |  微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. |  当液体变成红褐色时,停止加热,让光束通过体系时可产生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com