
| A | B | C | D | E | |
| 原子结构 | 失去电子后变成质子, | 最外层电子数是次外层电子数的3倍. | L层电子数等于K层和M层电子数之和. | 最外层电子排布为(n+1)sn(n+1)p(n+3). | |
| 物质性质 | 其最高价氧化物对应水化物的碱性是短周期元素中最强的. |
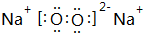 ,
, ;
;| 6-1×2 |
| 2 |


科目:高中化学 来源: 题型:
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.186 | 0.160 | 0.143 | 0.102 | 0.074 |
化合价 | +1 | +2 | +3 | +6,-2 | -2 |
下列叙述正确的是
A.L、M、Q三种元素处于同周期且元素的金属性依次增强
B.L、T两元素处于不同周期且可形成两种化合物
C.R、T两元素的氢化物分子间能形成氢键
D.L、M、Q、R四种元素的简单离子的核外电子数相等
查看答案和解析>>
科目:高中化学 来源:2012-2013学年昆明三中、滇池中学(本部)高一下期中考试化学卷(带解析) 题型:单选题
已知五种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
查看答案和解析>>
科目:高中化学 来源:2015届福建霞浦一中高一下学期第一次月考化学试卷(解析版) 题型:选择题
已知五种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A.L与T形成的化合物化学式为L2T3
B.L、M的单质与稀盐酸的反应速率:M > L
C.T、Q的氢化物常温常压下均为无色气体
D.M的最高价氧化物具有两性
查看答案和解析>>
科目:高中化学 来源:2010-2011学年上海市闵行区高三上学期质量调研考试化学试卷 题型:选择题
五种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.104 |
0.111 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+6、¯2 |
+2 |
¯2 |
下列叙述正确的是
A.R与M的单质及其化合物有相似的化学性质
B.L、M的单质均用电解其熔融的盐的方法冶炼而得
C.T的氢化物还原性及稳定性均比Q的氢化物强
D.五种元素的常见简单离子中半径最大的是Q2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com