
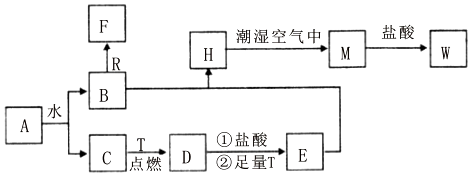
分析 依据转化关系和反应条件,A为淡黄色固体且能与水反应,所以A为Na2O2,T为生活中使用最广泛常的金属单质,则T为Fe,R是地壳中含量最多的金属,则R为Al,D是具有磁性的黑色晶体,则D为Fe3O4,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现红色,则W含有铁离子,过氧化钠与水反应生成B和C,铁与C反应生成Fe3O4,所以C为O2,B为NaOH,D与盐酸反应再与铁反应生成E为FeCl2,B与E反应生成H为Fe(OH)2,H与潮湿的空气反应生成M为Fe(OH)3,M与盐酸反应生成W为FeCl3,C、F是无色无味的气体,氢氧化钠与铝反应生成F为H2,据此答题.
解答 解:(1)根据上面的分析可知,D为Fe3O4,E为FeCl2,
故答案为:Fe3O4;FeCl2;
(2)氢气和空气混合在一定的范围内点燃会发生爆炸,点燃气体F为H2前必须先检验气体纯度,
故答案为:检验气体纯度;
(3)Fe(OH)2在潮湿空气中变成Fe(OH)3的,反反应现象为:白色沉淀迅速变为灰绿色,最终变为红褐色,应的化学方程式为:4Fe(OH)3+O2+2H2O=4Fe(OH)3,反应为化合反应,
故答案为:白色沉淀迅速变为灰绿色,最终变为红褐色;4Fe(OH)3+O2+2H2O=4Fe(OH)3;化合;
(4)NaOH和Al反应生成H2的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,含元素的化合价变化,为氧化还原反应,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;氧化还原.
点评 本题考查了物质转化关系的应用判断,物质性质的应用,主要考查铝及其化合物、铁及其化合物性质的应用,化学方程式、离子方程式书写方法,离子检验方法,物质的特征反应、现象、性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 硅可用于制造光导纤维 | |
| B. | 铝槽车可用于浓硫酸的贮运 | |
| C. | 铝热反应可用于焊接铁轨 | |
| D. | 呈液态钠钾合金可用于快中子反应堆的热交换剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝能够稳定存在于空气中,而铁很容易生锈,说明铁比铝活泼 | |
| B. | 等物质的量的Al、Fe分别与足量盐酸反应放出等质量的H2 | |
| C. | 二者的氢氧化物都不可以通过氧化物化合反应直接制备 | |
| D. | 二者的单质都能与强碱溶液反应生成H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出CO2的总量一样多 | B. | 前者生成的NaCl是后者的二倍 | ||
| C. | 消耗盐酸一样多 | D. | 后者消耗盐酸是前者的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是良好的半导体材料 | |
| B. | 二氧化硅能与石灰石反应:SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑ | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| D. | 水泥的主要成分是 Na2SiO3、CaSiO3 和 SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3和NaOH溶液反应:Al2O3+2OH-=2AlO2-+H2↑ | |
| B. | 过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | |
| C. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤②④①③ | B. | ④②⑤①③ | C. | ②⑤④①③ | D. | ⑤④②①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com