
短周期元素X、Y、Z在周期表中的位置关系如图所示,则下列叙述中正确的是()
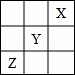
A. Z一定是活泼的金属元素
B. Y的最高价氧化物的水化物是一种强酸
C. Y的氢化物稳定性大于Z的氢化物稳定性
D. X、Y、Z各元素的最高正价与最低负价的绝对值之和均为8
考点: 元素周期律和元素周期表的综合应用.
专题: 元素周期律与元素周期表专题.
分析: X、Y、Z是短周期元素,根据元素在周期表中的位置知,X是He元素,Y是F元素,Z是S元素,
A.Z是S元素,为非金属元素;
B.Y是F元素,氟元素没有正化合价;
C.同一周期元素中,元素的非金属性随着原子序数的增大而增强,同一主族元素中,元素的非金属性随着原子序数的增大而减弱,元素的非金属性越强,其氢化物的稳定性越强;
D.Y没有正化合价,X一般不和其它元素反应.
解答: 解:X、Y、Z是短周期元素,根据元素在周期表中的位置知,X是He元素,Y是F元素,Z是S元素,
A.Z是S元素,为非金属元素而不是金属元素,故A错误;
B.Y是F元素,氟元素没有正化合价,所以没有最高价含氧酸,故B错误;
C.同一周期元素中,元素的非金属性随着原子序数的增大而增强,同一主族元素中,元素的非金属性随着原子序数的增大而减弱,元素的非金属性越强,其氢化物的稳定性越强,F元素的非金属性大于Cl元素,Cl元素的非金属性大于S元素,所以F元素的非金属性大于S元素,则氟化氢的稳定性大于硫化氢,故C正确;
D.Y没有正化合价,He元素的原子已经达到稳定结构,所以一般不和其它元素反应,故D错误;
故选:C.
点评: 本题考查了元素周期表和元素周期律的综合应用,根据元素在周期表中的位置及“短周期元素”来确定这三种元素,再结合元素周期律来分析解答,易错选项是B,注意氟元素虽然是非金属性最强的元素,但因为没有正化合价,所以没有最高价含氧酸.


科目:高中化学 来源: 题型:
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是()
A. 加入KSCN溶液一定不变红色 B. 溶液中一定含Fe2+
C. 溶液中一定不含Cu2+ D. 剩余固体中一定含Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的恒容容器中,反应A(s)+2B(g)⇌C(g)+D(g)已达平衡状态的是( )
|
| A. | 混合气体的压强不随时间变化而变化 |
|
| B. | 混合气体的密度不随时间变化而变化 |
|
| C. | 气体总物质的量不随时间变化而变 |
|
| D. | 单位时间内生成n mol C,同时消耗2n molB |
查看答案和解析>>
科目:高中化学 来源: 题型:
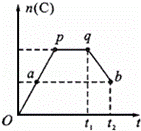
一定温度下,在一定容积的密闭容器中发生如下可逆反应:
2A(g)+B(g)⇌2C(g),在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度).试回答下列问题:
(1)a点时,反应的v(正) v(逆)(填“>”、“<”或“=”);
(2)此反应的逆反应为 热反应(填“放”或“吸”);
(3)a、b两点的正反应速率:v(a) v(b)(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,我国拥有完全自主产权的氢氧燃料电池车将在奥运会期间为运动员提供服务.某种氢氧燃料电池的电解液为KOH溶液.下列有关电池的叙述不正确的是()
A. 正极反应式为:O2+2H2O+4e﹣═4OH﹣
B. 工作一段时间后,电解液中的KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2═2H2O
D. 用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
由铜、锌和稀硫酸组成的原电池中(图1):
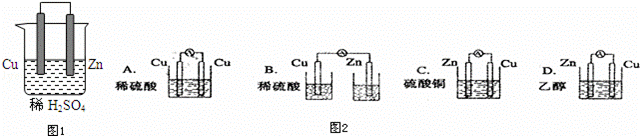
(1)锌是负极,电极反应式是 .铜是正极,电极反应式是 .总反应式
(2)在铜极上可以观察到 ,在锌极可以观察到 (填实验现象)
(3)图2装置能够组成原电池是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在两个密闭容器中,分别充有质量相同的甲乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是()
A. 若M(甲)>M(乙),则气体体积:甲<乙
B. 若M(甲)<M(乙),则气体压强:甲>乙
C. 若M(甲)>M(乙),则气体的摩尔体积:甲>乙
D. 若M(甲)<M(乙),则分子数:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中均发生如下反应:
2SO2(g)+O2(g)⇌2SO3(g)+197kJ
实验测得有关数据如表:
容器编号 起始时各物质的物质的量/mol 达到平衡时体系能量的变化/KJ
SO2 O2 SO3
甲 2 1 0 Q1
乙 1.8 0.9 0.2 Q2
丙 0 0 2 Q3
下列判断中正确的是()
A. 197>Q2>Q1
B. 若升高温度,反应的热效应不变
C. Q3=﹣197kJ
D. 生成1mol SO3(l)时放出的热量大于98.5kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com