
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )| A、图中AB段的氧化剂为K2Cr2O7 |
| B、图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 |
| C、开始加入的K2Cr2O7为0.25 mol |
| D、K2Cr2O7可与FeSO4反应的物质的量为1:3 |
| 1.5 |
| 6 |


科目:高中化学 来源: 题型:
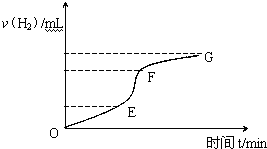 用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 盐酸的浓度/mol?L-1 | 滴定完成时,盐 酸滴入的体积/mL | 待测NaOH溶液 的体积/mL |
| 1 | 0.1152 | 26.72 | 25.00 |
| 2 | 0.1152 | 29.02 | 25.00 |
| 3 | 0.1152 | 26.70 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③④⑥ |
| C、①③④ | D、①②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下pH为5的盐酸溶液稀释1000倍后,pH等于8 |
| B、浓度均为0.1mol/L的氨水和氯化铵溶液,水电离出的c(H+)前者小于后者 |
| C、碳酸钠溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) |
| D、等浓度的CH3COOH与KOH以任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(1)(3) |
| B、(1)(4) |
| C、(1)(3)(4) |
| D、(2)(3)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A、X与Y可以形成阴离子XY32- |
| B、元素R的含氧酸一定为强酸 |
| C、Z的氢化物的沸点比T的氢化物的沸点高 |
| D、由X形成的化合物QX和XR4,其晶体类型不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大反应物浓度可以提高活化分子百分数 |
| B、升高温度能提高活化分子百分数 |
| C、使用合适的催化剂可以增大活化分子的能量 |
| D、增大体系的压强一定能提高活化分子百分数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com