
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,有以下三种:
部分氧化:CH4(g)+ ![]() O2(g)
O2(g)![]() CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
CO(g)+2H2(g) ΔH1=-35.9kJ·mol-1 ①
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH4 ④
2CO(g)+2H2(g) ΔH4 ④
则反应②自发进行的条件是________________,ΔH4 =_____________kJ·mol-1。
(2)起始向密闭容器中充入一定量的CH4(g)和O2(g),发生反应①。CH4(g)的平衡转化率与温度(T)和压强(P)的关系如图所示。
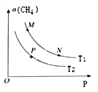
①N、P两点的平衡常数:K(N)_______K(P)(填“>”“<”或“=”),理由是_________。
②M、N两点的H2的物质的量浓度c(M)______c(N)(填“>”“<”或“=”)。
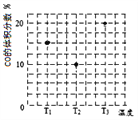
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g)![]() CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
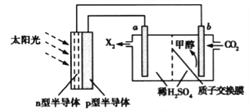
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等。则b极的电极反应式为___________________;当电路中有3mol电子转移时,质子交换膜两侧溶液相差_________g。
【答案】 高温 +247.1 > 反应①为放热反应,温度升高,平衡逆向移动,CH4(g)的平衡转化率降低,所以T1<T2,故P点平衡常数小于N点 < T3 9V2/2a2 CO2+6e﹣+6H+=CH3OH+H2O 52
【解析】(1)本题考查自发反应的判断和盖斯定律的应用,根据符合判据,△G=△H-T△S,自发进行要求△G<0,根据②反应,此反应是吸热反应,即△H>0,反应前气体的系数和小于反应后气体系数和,此反应是熵增,即△S>0, 此反应自发进行的条件是高温,根据盖斯定律,②-③得出△H4=(205.9+41.2)kJ·mol-1=+247.1kJ·mol-1;(2)考查化学平衡常数、影响化学平衡常数的因素、勒夏特列原理,反应①是放热反应,作等压线,升高温度,甲烷的转化率降低,即T2>T1,化学平衡常数只受温度的影响,因此根据化学平衡常数的定义,推出K(N)>K(P); ②N点的压强大于M点,依据勒夏特列原理,增大压强,平衡向体积减小的方向移动,针对反应①,增大压强平衡虽然向逆反应方向移动,但平衡移动的趋势微弱,组分浓度增大,即氢气的浓度c(M)<c(N);(3)本题考查化学平衡状态的判断、化学平衡常数的计算,随着反应的进行,CO的体积分数应是降低,当达到平衡,升高温度,平衡向逆反应方向进行,CO的体积分数增大,即T3达到平衡,T2不知道是不是最低点,无法确定是否达到平衡;CO(g) +2H2(g)![]() CH3OH(g)
CH3OH(g)
起始物质的量:a 2a 0
变化: x 2x x
平衡: a-x 2(a-x) x 根据图像,因此有(a-x)/(3a-2x)×100%=20%,解得x=2a/3,根据平衡常数的表达式,K= 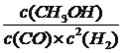 ,代入数值,解得K=9V2/2a2;(4)本题考查电极反应式的书写和电化学计算,根据工作原理,b极上生成甲醇,且此装置的环境是酸性,因此b电极反应式为CO2+6e﹣+6H+=CH3OH+H2O,a极反应式为2H2O-4e-=O2↑+4H+,b极溶液增加CO2和H+量,a极溶液减少O2和H+的量,当电路中有3mol电子转移,b极增加了1/2molCO2和3molH+,即质量增加为(22+3)g=25g,a极减少3/4molO2,为了平衡b极阴离子,需要从a电极向b电极移动3molH+,即b极质量减少(24g+3g)=27g,因此两极溶液质量相差(27+25)g=52g。
,代入数值,解得K=9V2/2a2;(4)本题考查电极反应式的书写和电化学计算,根据工作原理,b极上生成甲醇,且此装置的环境是酸性,因此b电极反应式为CO2+6e﹣+6H+=CH3OH+H2O,a极反应式为2H2O-4e-=O2↑+4H+,b极溶液增加CO2和H+量,a极溶液减少O2和H+的量,当电路中有3mol电子转移,b极增加了1/2molCO2和3molH+,即质量增加为(22+3)g=25g,a极减少3/4molO2,为了平衡b极阴离子,需要从a电极向b电极移动3molH+,即b极质量减少(24g+3g)=27g,因此两极溶液质量相差(27+25)g=52g。


科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化.下列说法正确的是( ) 
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和 O2混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X,Y,Z,W为短周期元素,原子半径X:99pm Y:154pm Z:125pm W:117pm,X,Y,W位置如图所示(副族省略),X,Y,Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是( ) 
A.元素Z处于周期表的阴影位置
B.非金属性:X>W
C.X与W形成化合物熔点很高,为离子化合物
D.Y,W的最高价氧化物对应的水化物能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是炼铜的最主要矿物。火法冶炼黄铜矿的过程中,其中一步反应是;2Cu2O+ Cu2S![]() 6Cu+SO2。回答下列问题。
6Cu+SO2。回答下列问题。
(1)Cu+的价电子轨道表示式为__________________;Cu2O与Cu2S比较,熔点较高的是_______,原因为_____________________________________。
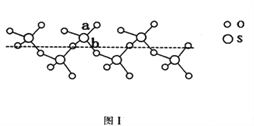
(2)SO2与SO3的键角相比,键角更大的是____________。将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图1所示。此固态SO3中S原子的杂化轨道类型是_______;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为_________(填图中字母)。
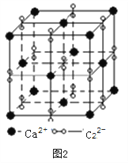
(3)离子化合物CaC2的一种晶体结构如下图2所示。写出该物质的电子式_____。从钙离子看,属于____________堆积;一个晶胞含有的π键平均有______个。

(4)奥氏体是碳溶解在γ—Fe中形成的一种间隙固溶体,无磁性,其晶胞如上图3所示,则该物质的化学式为________,若晶体密度为dg/cm3,则晶胞中最近的两个碳原子的距离为____________________ pm。(阿伏加德罗常数的值用NA表示,写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要的金属。
(1)铝在元素周期表中的位置是_______________________________。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为____________。铝热反应也可以用于金属的冶炼,有同学认为将氧化镁和铝分放一起在高温下可用于镁的冶炼,你认为此说法________(填对或不对),认为不对的请说出原因____________________________并写出镁的冶炼的化学方程式 ________________________________________(认为对的此项可不作答)。
(3)铝与NaOH溶液反应的离子方程式为_____________________;
(4)以AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括①________,②冷却结晶,③过滤。在第①步操作中应注意的事项是__________________。
(5).加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,此操作应注意在___________ ,其原因是(结合化学方程式简要说明)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. H+ Na+ CO32- Cl- B. Ba2+ Na+ Cl- SO42-
C. K+ H+ SO42- OH- D. Ag+ Al3+ NO3- H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com