(2011?上海)实验室用浓度为0.500mol/L的标准氢氧化钠溶液来测定未知浓度的盐酸,完善下列实验过程:
(1)滴定管使用前,先要检查滴定管的活塞
是否漏液
是否漏液
,活塞旋转是否灵活.
(2)把标准氢氧化钠溶液注入用标准氢氧化钠溶液润洗过的蓝色手柄滴定管中,使液面位于
0刻度或0刻度以下
0刻度或0刻度以下
位置,记录读数.
(3)在锥形瓶中放入20.00mL的待测溶液,再滴加2滴酚酞,摇匀.用标准氢氧化钠溶液滴定,边滴边摇动锥形瓶,眼睛注视
锥形瓶中溶液颜色
锥形瓶中溶液颜色
的变化.直到滴入最后一滴氢氧化钠溶液,指示剂的颜色由
无
无
色变为
粉红
粉红
色,并在半分钟内溶液颜色不发生变化,停止滴定,记录读数.
(4)重复(2)和(3)操作,并记录数据.再次滴定消耗氢氧化钠溶液的数据如下表:
| 次数 |
滴定前(mL) |
滴定后(mL) |
| 1 |
0.40 |
21.10 |
| 2 |
0.10 |
|
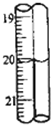
第2次滴定后滴定管的读数如图所示,将这一读数填入上表中.根据表中的数据计算出盐酸的浓度为
0.496
0.496
mol/L.
已知盐酸的准确浓度为0.490mol/L,则实验误差为
1.2
1.2
%.
(5)会造成实验结果偏高的操作是
c
c
(填写编号).
a.锥形瓶用蒸馏水洗净后,立即装入待测溶液
b.振荡时溶液溅出锥形瓶外
c.滴定时蓝色手柄滴定管中的液体滴在锥形瓶外.



 第2次滴定后滴定管的读数如图所示,将这一读数填入上表中.根据表中的数据计算出盐酸的浓度为
第2次滴定后滴定管的读数如图所示,将这一读数填入上表中.根据表中的数据计算出盐酸的浓度为