
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验小组成员经讨论认定猜想丁不成立,理由是_______________________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
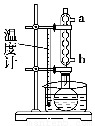
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E中有气泡连续放出,表明__________。
②称取Mg(NO3)2固体3.7 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是________;关闭k,用酒精灯加热时,正确操作是先________,然后固定在管中固体部位下加热。
③观察到A中有红棕色气体出现,C、D中未见明显变化。
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想______是正确的。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:______________(填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是__________
____________________________________________________。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步探究。
(1)不符合氧化还原反应原理(或其他合理答案)(2)①装置气密性良好 ②避免对产物O2的检验产生干扰(或其他合理答案)移动酒精灯预热硬质玻璃管
(3)①乙 ②2Na2SO3+O2=2Na2SO4 O2在通过装置B时已参与反应(或其他合理答案)
【解析】 (1)丁产物中只有N的化合价降低,没有化合价升高的,不符合电子守恒规律。(2)在做有关气体多步连续实验时,首先应检查装置的气密性,还要考虑装置中的空气对产物的生成及检验是否会产生影响,若有干扰必须先排净干扰气体。对玻璃加热时要先均匀预热,再集中加热。(3)①不可能是甲,因为甲中Mg(NO2)2可溶于水。不可能是丙,因为丙中Mg3N2能与水反应产生NH3和Mg(OH)2沉淀。
只能是乙, Mg(NO3)2 ~ MgO
148 40
3.7 g m
m=40× =1.0 g
=1.0 g
氧化镁难溶于水,且符合质量变化。
②Na2SO3具有还原性,能被O2氧化;NO2和O2可被NaOH共同吸收。


科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第5讲化学反应与能量练习卷(解析版) 题型:选择题
已知:①1 g氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,②中和热为57.3 kJ·mol-1,③C(石墨s)=C(金刚石s) ΔH=+1.90 kJ·mol-1,下列说法正确的是( )。
A.氢气的燃烧热为241.8 kJ·mol-1
B.氢气燃烧的热化学方程式:2H2+O2=2H2O ΔH=-483.6 kJ·mol-1
C.盐酸和氨水混合的热化学方程式:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
D.由③可知金刚石不及石墨稳定
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第1讲物质的组成性质和分类练习卷(解析版) 题型:填空题
分类思想以及用分类思想研究一类物质的通性和特殊性是学习化学的一种重要思维方式和手段。以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:

(1)上述第一级分类标准(分成A、B组的依据)是____________________。
(2)F组中物质除了Cl2外还有________(填化学式)。
(3)D组中的氨水呈弱碱性,用电离方程式表示其呈弱碱性的原因:
______________________________________________________________。
(4)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,用离子方程式说明理由:_______________________________________________________。
(5)FeCl3的水溶液滴入沸水可得到以Fe(OH)3为分散质的红褐色胶体
①该红褐色胶体中Z(OH)3粒子的直径大小范围是______________。
②FeCl3溶液滴入沸水可得到Fe(OH)3红褐色胶体的反应的离子方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第15讲实验化学练习卷(解析版) 题型:实验题
阿司匹林可由水杨酸与乙酸酐作用制得。其制备原理如下:


阿司匹林(乙酰水杨酸)的钠盐易溶于水。阿司匹林可按如下步骤制取和纯化:
步骤1:在干燥的50 mL圆底烧瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡使水杨酸全部溶解。
步骤2:按图所示装置装配好仪器,通水,在水浴上加热回流5~10 min,控制水浴温度在85~90 ℃。
步骤3:反应结束后,取下反应瓶,冷却,再放入冰水中冷却、结晶、抽滤、冷水洗涤2~3次,继续抽滤得粗产物。
步骤4:将粗产物转移至150 mL烧杯中,在搅拌下加入25 mL饱和碳酸氢钠溶液,充分搅拌,然后过滤。
步骤5:将滤液倒入10 mL 4 mol·L-1盐酸,搅拌,将烧杯置于冰浴中冷却,使结晶完全。抽滤,再用冷水洗涤2~3次。
(1)步骤1浓硫酸的作用可能是________。
(2)步骤2中,冷凝管通水,水应从________口进(填“a”或“b”)。
(3)步骤3抽滤时,有时滤纸会穿孔,避免滤纸穿孔的措施是______________________________________________________________。
(4)步骤4发生主要反应的化学方程式为_____________________;过滤得到的固体为________。
(5)取几粒步骤5获得的晶体加入盛有5 mL水的试管中,加入1~2滴1%三氯化铁溶液,发现溶液变紫色,可采用________方法,进一步纯化晶体。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第13讲实验方案设计与评价练习卷(解析版) 题型:实验题
用氯化铁浸出?重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[w(Fe)],实验步骤如下:
步骤1:称取试样0.100 g于250 mL洗净的锥形瓶中。
步骤2:加入FeCl3溶液100 mL,迅速塞上胶塞,用电磁搅拌器搅拌30 min。
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中。
步骤4:将滤液稀释至500 mL,再移取100 mL稀释液于锥形瓶中,加入20 mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴。
步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点。发生的反应为Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤6:重复测定两次。
步骤7:数据处理。
(1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为________________,迅速塞上胶塞的原因是______________________________
(2)步骤3中判断滤纸上残渣已洗净的方法是_____________________________
(3)实验中需用到100 mL浓度约为0.01 mol·L-1K2Cr2O7标准溶液,配制时用到的玻璃仪器有________________。称量K2Cr2O7固体前应先将其烘干至恒重,若未烘干,对测定结果的影响是________(填“偏高”、“偏低”或“无影响”);滴定时,K2Cr2O7溶液应置于________(填仪器名称)中。
(4)科研人员为确定FeCl3溶液的最佳浓度,选用100 mL不同浓度的FeCl3溶液(FeCl3溶液均过量)溶解同一钛精粉试样,其余条件控制相同,得到测定结果如图所示。则FeCl3溶液的浓度[用ρ(FeCl3)表示]范围应为________g·L-1,浓度过低或过高时测定结果偏低的原因分别是_________________________。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第12讲化学实验基础练习卷(解析版) 题型:选择题
下列有关实验操作、实验现象和结论都正确的是( )。
选项实验操作实验现象结论
A在Ba(NO3)2溶液中分别滴入H2SO3和H2SO4溶液均有白色沉淀 沉淀均为BaSO4
B混合装有Cl2和NH3两集气瓶中的气体产生大量白烟NH3显还原性和碱性
C溶液X中滴入盐酸酸化的FeCl3溶液,再滴入淀粉溶液溶液变蓝色溶液X中一定含有I-
D向浓度均为0.01 mol·L-1的NaCl和Na2S的混合溶液中滴入少量AgNO3溶液出现黑色沉淀 Ksp(Ag2S)> Ksp(AgCl)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第12讲化学实验基础练习卷(解析版) 题型:选择题
下列实验操作正确的是( )。
A.用100 mL容量瓶配制50 mL 0.1 mol·L-1 H2SO4溶液
B.中和热测定的实验中使用的玻璃仪器只有2种
C.分液漏斗、滴定管、容量瓶在使用前均需检查是否漏水
D.漂白粉能露置在空气中保存
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第10讲金属元素及其化合物练习卷(解析版) 题型:选择题
海水是重要的资源。可以制备一系列物质(见图)。

下列说法正确的是( )。
A.步骤②中,应先通NH3,再通CO2
B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
C.步骤④、⑤、⑥反应中,溴元素均被氧化
D.除去粗盐中的SO32—、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题7水溶液中的离子平衡练习卷(解析版) 题型:填空题
现有浓度均为0.1 mol·L-1的下列溶液:
①硫酸、②醋酸溶液、③氢氧化钠溶液、④氯化铵溶液、⑤醋酸铵溶液、⑥硫酸铵溶液、⑦硫酸氢铵溶液、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________。
(3)将③和④等体积混合后,混合液中各离子浓度关系正确的是________。
A.c(Na+)=c(Cl-)>c(OH-)>c(NH4+)
B.c(Na+)=0.1 mol·L-1
C.c(Na+)+c(NH4+)=c(Cl-)+c(OH-)
D.c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com