
分析 因焰色反应为黄色,说明五种物质都含有钠元素,根据钠及其化合物的性质,可推知各物质.E为NaCl,可燃气体是氢气,B为Na,
无色无味气体H能使澄清石灰水变浑浊,则H为CO2,F和H也可反应生成C和另一种无色无味气体,则无色无味气体为氧气,F为Na2O2,C为Na2CO3,C、D与盐酸反应生成一种无色无味气体H,D和A可反应生成C,则D为NaHCO3,A为NaOH,以此解答该题.
解答 解:因焰色反应为黄色,说明五种物质都含有钠元素,根据钠及其化合物的性质,可推知各物质.E为NaCl,可燃气体是氢气,B为Na,
无色无味气体H能使澄清石灰水变浑浊,则H为CO2,F和H也可反应生成C和另一种无色无味气体,则无色无味气体为氧气,F为Na2O2,C为Na2CO3,C、D与盐酸反应生成一种无色无味气体H,D和A可反应生成C,则D为NaHCO3,A为NaOH,
(1)由以上分析可知,A为NaOH,B为Na,C为Na2CO3,D为NaHCO3,E为NaCl,F为Na2O2,故答案为:NaOH;Na;NaCl;
(2)F为Na2O2,可与二氧化碳反应生成碳酸钠和氧气,反应的方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)①D为NaHCO3,不稳定,加热易分解,方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
②C为Na2CO3,与盐酸反应生成二氧化碳气体,离子方程式为CO32-+2H+=CO2↑+H2O,故答案为:CO32-+2H+=CO2↑+H2O;
③A为NaOH,与铝反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查无机物的推断,侧重于考查学生的综合分析能力,不但要求同学们具备有关物质的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.解题时需要认真分析题目给出的条件,联系实际,逐一分析推断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| C. | 1mol烃基与17gNH3所含电子数之比为9:10 | |
| D. | 一定温度下1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl含NH4+的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量(kJ) | 243 | 193 | 151 | 436 | 565 | 431 | 363 | 297 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 2L0.5mol/L亚硫酸溶液中含有的氢离子数为2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
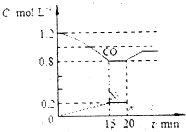 CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题
CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属活动性:A>B | |
| B. | A极是正极,电解质溶液可以是盐酸 | |
| C. | B极是负极 | |
| D. | 要判断A极与B极是正极还是负极,还需考虑电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
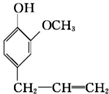 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: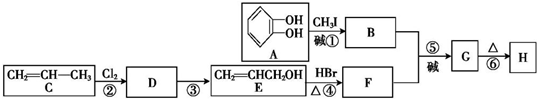
 +RX$\stackrel{碱}{→}$
+RX$\stackrel{碱}{→}$ +HX(X代表卤素原子);
+HX(X代表卤素原子); .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由题目信息知:KMnO4的氧化性比MnO2的强 | |
| B. | 制备氯气的整个实验过程中,只需要使用氧化剂与还原剂 | |
| C. | 用排气法收集不需要利用其他试剂就能确定集气瓶中已收集满气体 | |
| D. | 用足量MnO2与含有4 molHCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com