
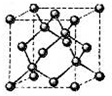
 有A、B、C、D、E五种元素(A、B、C、D、E分别代表元素符号),其中A元素原子核内只有一个质子;B元素的基态原子s亚层的总电子数比p亚层的总电子数多1;C元素的原子最外层电子数是次外层电子数的3倍;D位于B的下一周期,在同周期元素形成的简单离子中,D形成的简单离子半径最小;E的基态原子中电子排布在三个能级上,且这三个能级所含电子数均相同.
有A、B、C、D、E五种元素(A、B、C、D、E分别代表元素符号),其中A元素原子核内只有一个质子;B元素的基态原子s亚层的总电子数比p亚层的总电子数多1;C元素的原子最外层电子数是次外层电子数的3倍;D位于B的下一周期,在同周期元素形成的简单离子中,D形成的简单离子半径最小;E的基态原子中电子排布在三个能级上,且这三个能级所含电子数均相同.| 5+1-2×3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |
| b |
| NA |
8×
| ||
| a3 cm3 |
| 8b |
| a3NA |
| 8b |
| a3NA |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
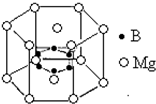 镁、钙、钾、溴、氟、硼等元素在每升海水中的含量都大于1mg,属于海水中的常量元素.
镁、钙、钾、溴、氟、硼等元素在每升海水中的含量都大于1mg,属于海水中的常量元素.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
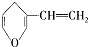 互为同分异构体的芳香族化合物中能与NaOH反应的以及不能与NaOH反应的种类分别有( )
互为同分异构体的芳香族化合物中能与NaOH反应的以及不能与NaOH反应的种类分别有( )| A、3种和1种 |
| B、2种和3种 |
| C、3种和2种 |
| D、4种和1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最外层只有一个电子,反应中易失去 |
| B、随核电荷数增加熔点升高 |
| C、随核电荷数增加氢氧化物的碱性增强 |
| D、随核电荷数增加跟水反应更加剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质分子中一定含有共价键 |
| B、由非金属元素组成的化合物不一定是共价化合物 |
| C、ⅠA族和ⅦA族原子化合时,一定生成离子键 |
| D、.离子化合物中可能含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com