
| A. | ①②④⑥ | B. | ②④⑥ | C. | ①③⑤ | D. | ①②③⑥ |
分析 ①元素周期表中的对角线规则:处于对角线的元素具有相似性;
②铊(Tl)远离金属和非金属的分界线,为金属元素,不与氢氧化钠溶液反应;
③同主族元素性质具有相似性,根据卤素元素性质推断;
④金属li的活泼性比Na弱,燃烧时生成氧化锂,不会生成Li2O2;
⑤硫酸锶(SrSO4)的性质与硫酸钡类似;
⑥非金属性越强,氢化物的稳定性越强,结合非金属性Se<S分析.
解答 解:①根据对角线规则,Be和Al的性质相似,氢氧化铝具有两性,则铍(Be)的氧化物的水化物可能具有两性,故①正确;
②铊(Tl)远离金属和非金属的分界线,属于金属元素,只能和盐酸作用产生氢气,不能与NaOH溶液反应,故②错误;
③根据卤族元素性质递变性,HAt不稳定,AgAt感光性很强,不溶于水也不溶于稀酸,故③正确;
④Li的活泼性比Na弱,锂(Li)在氧气中剧烈燃烧产物只是Li2O,无Li2O2,故④错误;
⑤硫酸锶(SrSO4)类似硫酸钡,是难溶于水的白色固体,故⑤正确;
⑥Se元素非金属性弱于S的非金属性,如H2S应该比H2Se稳定,故⑥错误;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,明确元素周期律内容为解答关键,注意掌握元素周期表中对角线规则的内容及应用方法,试题侧重考查学生的分析能力及逻辑推理能力.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
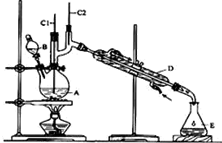 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子结构示意图 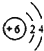 ,可以表示12C原子或13C原子 ,可以表示12C原子或13C原子 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 次氯酸的电子式 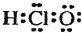 | |
| D. | CO2的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向原溶液中通入常温常压下的HCl气体22.4V L,使其完全溶解 | |
| B. | 将溶液加热浓缩到0.5V L | |
| C. | 向原溶液中加入10.00 mol•L-1的盐酸0.2V L,再稀释至1.5V L | |
| D. | 向原溶液中加入V L 3 mol•L-1的盐酸混合均匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:3 | B. | 3:1 | C. | 1:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com