
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
![]()
已知转化过程中的反应为2CrO42-(aq)+2H+(aq) ![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有![]() 转化为Cr2O72-,下列说法不正确的是( )
转化为Cr2O72-,下列说法不正确的是( )
A.溶液颜色保持不变,说明上述可逆反应达到平衡状态
B.若用FeSO4作还原剂,处理1L废水,至少需要1.65mol
C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
【答案】C
【解析】
由于转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有![]() 转化为Cr2O72-,所以溶液中CrO42-的浓度为
转化为Cr2O72-,所以溶液中CrO42-的浓度为![]() ,而Cr2O72-的浓度为
,而Cr2O72-的浓度为![]() 。
。
A. CrO42-为黄色,Cr2O72-为橙红色,当溶液颜色保持不变时,说明上述可逆反应达到平衡状态,故A项正确;
B. 1L废水中+6价的铬元素的物质的量为![]() ,要使+6价的铬元素转化为+3价的铬元素,根据得失电子守恒,需要的绿矾的物质的量为0.55×2=1.65mol,故B项正确;
,要使+6价的铬元素转化为+3价的铬元素,根据得失电子守恒,需要的绿矾的物质的量为0.55×2=1.65mol,故B项正确;
C. 由平衡常数![]() ,解得pH=6,故C项错误;
,解得pH=6,故C项错误;
D. Cr3+与氢氧根生成沉淀的离子方程式为![]() ,所以
,所以![]() ,常温下其
,常温下其![]() ,所以处理后废水中氢氧根离子浓度为
,所以处理后废水中氢氧根离子浓度为![]() ,所以溶液的pH=5,故D项正确;
,所以溶液的pH=5,故D项正确;
故答案选C。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】某小组同学利用下图装置(夹持仪器已省略)制备溴苯,并探究该反应原理。
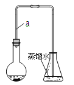
I.制备溴苯
(1)装置中长导管a的作用是______、导出气体,制备溴苯的反应方程式属于______反应,其方程式为________
(2)本实验所获得的溴苯为褐色,是因为________________。
II.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃。同学们设计了如下流程:
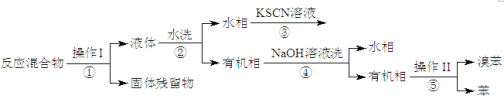
(3)操作Ⅱ为_____________。
(4)流程②和④中,需要用到的玻璃仪器是烧杯、_______;流程③的现象为______,流程④的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________________。
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= ________。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
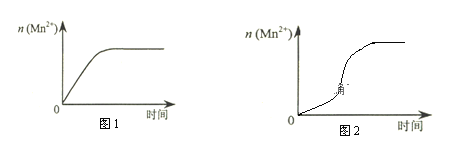
①该小组同学提出的假设是___________________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L稀硫酸 | 0.05mol/L KMnO4溶液 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | _______ | t |
③若该小组同学提出的假设成立,应观察到的现象是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中充满NO2,常温下建立下列平衡:2NO2(g)![]() N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
A.颜色B.压强C.质量D.平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种常用于缓解哮喘等肺部疾病的新型药物,一种合成路线如图:

已知:RX+ ![]() +HX。请回答:
+HX。请回答:
(1)化合物D中官能团的名称为______。
(2)化合物C的结构简式为______。
(3)①和④的反应类型分别为______,______。
(4)反应⑥的化学方程式为______。
(5)下列说法正确的是______。
A.化合物B能发生消去反应
B.化合物H中两个苯环可能共平面
C.1mol 化合物F最多能与5mol NaOH反应
D.M的分子式为C13H19NO3
(6)同时符合下列条件的化合物A的同分异构体有______种(不包括立体异构),其中核磁共振氢谱有5组峰的结构简式为______。①能与FeCl3溶液发生显色反应②能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A. M点对应的溶液中:K+、Fe2+、SO42-、NO3-
B. N点对应的溶液中:K+、NH4+、Cl-、CO32-
C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3-
D. R点对应的溶液中:Na+、SO42-、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,下列有关曲线与对应的叙述正确的是
时,下列有关曲线与对应的叙述正确的是
A.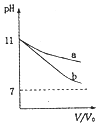 如图可表示体积均为
如图可表示体积均为![]() L、pH均为11的氨水与NaOH溶液分别用水稀释至VL情况,则b曲线为氨水
L、pH均为11的氨水与NaOH溶液分别用水稀释至VL情况,则b曲线为氨水
B.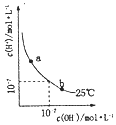 如图可表示水溶液中
如图可表示水溶液中![]() 与
与![]() 的浓度变化曲线,则升髙温度可实现
的浓度变化曲线,则升髙温度可实现![]()
C. 如图可表示体积均为100mL、pH均为3的盐酸与醋酸,分别与
如图可表示体积均为100mL、pH均为3的盐酸与醋酸,分别与![]() gZn反应,则a表示盐酸
gZn反应,则a表示盐酸
D. 如图可表示体积为
如图可表示体积为![]() 1
1![]() 盐酸用水稀释至VL情况,则
盐酸用水稀释至VL情况,则![]() 范围内:
范围内:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的个数是
①含氧的化合物一定是氧化物
②盐的组成中一定含有金属元素
③![]() 一元酸溶液中
一元酸溶液中![]() 浓度一定为
浓度一定为![]()
④强酸溶液中的![]() 浓度一定大于弱酸溶液中的
浓度一定大于弱酸溶液中的![]() 浓度
浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥![]() 水溶液电离时生成的阳离子有氢离子,所以是酸
水溶液电离时生成的阳离子有氢离子,所以是酸
A.1个B.2个C.3个D.4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1) 若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L。样品中铝的质量是_____________g。
(2) 若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是:________,氧化铁与铝的质量比是________。
(3) 待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c∶b=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com