
【题目】将0.4molMnO2和100mL12mol/L盐酸混合后加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸挥发)
A.等于0.6molB.小于0.6molC.大于0.6molD.等于0.3mol
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】最活泼的金属元素、最活泼的非金属元素、常温下呈液态的金属(价电子排布为5d106s2)元素分别位于下面元素周期表中的( )
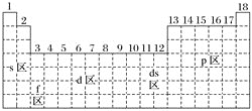
A. s区、p区、ds区 B. s区、p区、d区
C. f区、p区、ds区 D. s区、f区、ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L
CH3COOH溶液滴定曲线如右图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+ c(OH-) =c(CH3COOH)+ c(H+)
B. 点②所示溶液中:c(Na+) =c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
D. 滴定过程中可能出现:c(CH3COOH)> c(CH3COO-)> c(H+)> c(Na+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. H2S的燃烧热是Q kJ/mol。充分燃烧H2S,当有0.5Q kJ热量放出时,转移的电子数为6NA
B. 25℃时,500mL pH=11的碳酸钠溶液中,由水电离出的OH-数目为0.0005 NA
C. pH=2的H3PO4溶液中,H+的数目为0.01NA
D. 0.10 L 2.0 mol·L-1的NaHCO3溶液中HCO3-和CO32-的离子数之和为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2mol A和3mol B充入一密闭容器中,发生反应:aA(g)+ B(g)![]() C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )

A. a=2
B. 达到平衡时A的转化率为60%
C. 速率随时间变化关系如图所示
D. 为提高A的转化率,可采取升高温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门.以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
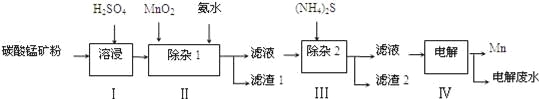
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10﹣13 | 3.0×10﹣16 | 5.0×10﹣16 | 1.0×10﹣11 | 5.0×10﹣22 | 1.0×10﹣22 |
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 ;
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③ ;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是 ;
加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(4)步骤Ⅲ中,需要用到的玻璃仪器除玻璃棒、漏斗外,还有 ;滤渣2的主要成分是 ;
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.欲使溶液中c(Mn2+)≤1.0×10﹣5molL﹣1,则应保持溶液中c(S2﹣)≥ molL﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.向蒸馏水中滴加浓H2SO4时,KW不变
B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12
C.Na2CO3水解的离子方程式为:CO32- + 2H2O![]() H2CO3 + 2OH-
H2CO3 + 2OH-
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 加催化剂有利于氨的催化氧化反应
B. 实验室用排饱和食盐水的方法收集氯气
C. 500℃左右比室温更有利于合成氨的反应
D. 压缩H2(g)、I2(g)、HI(g)平衡体系,体系颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是

A. 实验进程中水的电离程度:a>c>b
B. 向a点所示溶液中通入SO2,溶液的pH减小,漂白性增强
C. c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com