
| 压强(kPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
分析 (1)压强从 200kPa 增加到500kPa,增大了2.5倍,B的浓度从0.04mol/L增大到0.1mol/L,也增大了2.5倍,说明a=b+c,改变压强平衡不移动;
(2)压强增大的倍数为1000kPa/500kPa=2,B的浓度增大的倍数为0.27mol/L/0.1mol/L=2.7,浓度增大的倍数大于压强增大的倍数,所以平衡向“正向”移动;
(3)压强从 200kPa 增加到500kPa,增大了2.5倍,B的浓度从0.04mol/L增大到0.1mol/L,也增大了2.5倍,说明a=b+c,改变压强平衡不移动.
解答 解:(1)根据表中数据,压强从 200kPa增加到500kPa,增大了2.5倍,B的浓度从0.04mol/L增大到0.1mol/L,也增大了2.5倍,说明浓度增大的倍数和压强增大的倍数相同,化学计量数满足a=b+c,改变压强化学平衡不移动,
故答案为:不;浓度增大的倍数和压强增大的倍数相同;
(2)利用表中数据可知,压强增大的倍数为1000kPa/500kPa=2,B的浓度增大的倍数为0.27mol/L/0.1mol/L=2.7,浓度增大的倍数大于压强增大的倍数,说明加压至1000kPa时,C物质变成了非气态物质,所以增大压强化学平衡向“正向”移动,
故答案为:正向;加压至1000kPa时,C物质变成了非气态物质;
(3)由(1)得出,化学方程式中的化学计量数的关系是:a=b+c,故答案为:=.
点评 本题考查了化学平衡状态的影响因素,关键是分析题中表格的数据,得出正确结论,充分考查了学生的分析、理解能力,是一道不错的题目,本题难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
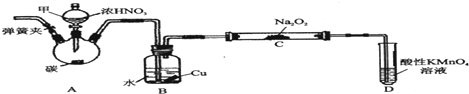

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水能被弱酸醋酸中和 | |
| B. | 铵盐受热易分解 | |
| C. | 氨水可以使酚酞试液变红 | |
| D. | 0.lmol/L氨水溶液,常温时pH约为11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 30% | C. | 50% | D. | 90% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “中和热的测定”实验步骤为:
“中和热的测定”实验步骤为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 | |
| B. | 等质量的O2和O3中所含的氧原子数不同 | |
| C. | 等质量的SO2与SO3中所含硫原子数之比为5:4 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com