

 为原料合成重要的化工产品
为原料合成重要的化工产品 的路线流程图(无机试剂任选)合成路线流程图示例如图2.
的路线流程图(无机试剂任选)合成路线流程图示例如图2.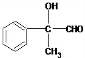 ,C氧化得D,则C为
,C氧化得D,则C为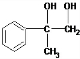 ,A与溴水反应生成B,B再生成C,可推得故A为
,A与溴水反应生成B,B再生成C,可推得故A为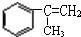 ,与溴水发生加成反应,生成B为
,与溴水发生加成反应,生成B为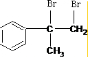 ,B再在碱性条件下发生水解得C,根据反应⑦的产物可知,F发生加聚反应生成高聚物,则F为
,B再在碱性条件下发生水解得C,根据反应⑦的产物可知,F发生加聚反应生成高聚物,则F为 ,E与甲醇发生在酯化反应生成F,则E为
,E与甲醇发生在酯化反应生成F,则E为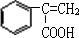 ,所以反应⑤为消去反应,(5)中以CH3COOH,
,所以反应⑤为消去反应,(5)中以CH3COOH, 为原料合成重要的化工产品
为原料合成重要的化工产品 ,应先制备
,应先制备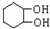 ,可由
,可由 经消去、加成、水解后生成,据此解答.
经消去、加成、水解后生成,据此解答. ,C氧化得D,则C为
,C氧化得D,则C为 ,A与溴水反应生成B,B再生成C,可推得故A为
,A与溴水反应生成B,B再生成C,可推得故A为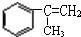 ,与溴水发生加成反应,生成B为
,与溴水发生加成反应,生成B为 ,B再在碱性条件下发生水解得C,根据反应⑦的产物可知,F发生加聚反应生成高聚物,则F为
,B再在碱性条件下发生水解得C,根据反应⑦的产物可知,F发生加聚反应生成高聚物,则F为 ,E与甲醇发生在酯化反应生成F,则E为
,E与甲醇发生在酯化反应生成F,则E为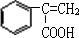 ,所以反应⑤为消去反应,(5)中以CH3COOH,
,所以反应⑤为消去反应,(5)中以CH3COOH, 为原料合成重要的化工产品
为原料合成重要的化工产品 ,应先制备
,应先制备 ,可由
,可由 经消去、加成、水解后生成,
经消去、加成、水解后生成,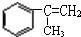 ,D结构简式为
,D结构简式为 ,
,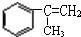 ;
; ;
;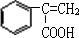 +CH3OH
+CH3OH| 浓H2SO4 |
| △ |
 +H2,
+H2,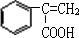 +CH3OH
+CH3OH| 浓H2SO4 |
| △ |
 +H2O;
+H2O; 为原料合成重要的化工产品
为原料合成重要的化工产品 ,应先制备
,应先制备 ,可由
,可由 经消去、加成、水解后生成,则反应的流程为
经消去、加成、水解后生成,则反应的流程为 ,
, .
.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
| A、Ca2++2OH-=Ca(OH)2↓ CaCO3+2NaOH=Ca(OH)2↓+Na2CO3 |
| B、Ba2++SO42-=BaSO4↓ Ba(OH)2+H2SO4=BaSO4↓+2H2O |
| C、Ag++Cl-=AgCl↓ AgNO3+NaCl=AgCl↓+NaNO3 |
| D、Fe3++3OH-=Fe(OH)3↓ FeCl3+3NH3?H2O=Fe(OH)3↓+3NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
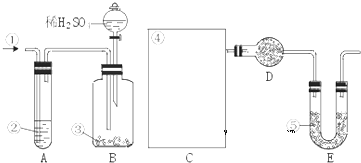
查看答案和解析>>
科目:高中化学 来源: 题型:
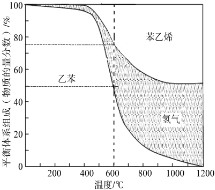 碳及其化合物是一类种类繁多的大家族.
碳及其化合物是一类种类繁多的大家族.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
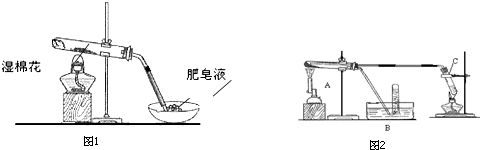
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验I中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、Mg2+的总含量 |
| B、Ca2+的含量 |
| C、Mg2+的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com