
| A. | pH=7 | B. | pH≥7 | C. | pH≤7 | D. | C(H+)•C(OH-)=10-14 |
分析 常温下,pH=2的酸中氢离子浓度是0.01mol/L,pH=12的氢氧化钠溶液中氢氧根离子浓度是0.01mol/L,酸可能是强酸或弱酸,如果是强酸,二者恰好反应生成强酸强碱盐和水,如果是弱酸,二者混合后酸有剩余,据此分析解答.
解答 解:常温下,pH=2的酸中氢离子浓度是0.01mol/L,pH=12的氢氧化钠溶液中氢氧根离子浓度是0.01mol/L,酸可能是强酸或弱酸,如果是强酸,二者恰好反应生成强酸强碱盐和水,溶液呈中性;如果是弱酸,二者混合后酸有剩余,酸的电离程度大于酸根离子水解程度,导致溶液呈酸性,则溶液的pH≤7,温度不变水的离子积常数不变,所以该温度下C(H+)•C(OH-)=10-14,
故选CD.
点评 本题考查溶液酸碱性定性判断,为高频考点,明确混合溶液中溶质及其性质是解本题关键,注意:离子积常数只与温度有关,与溶液酸碱性无关,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| C. | SO2具有漂白性,可用于漂白纸浆,也可以用于漂白食品 | |
| D. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
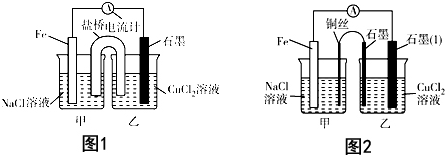

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.96L | B. | 4.48L | C. | 6.72L | D. | .3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、CH3COO- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2CO3的溶液:K+、Ca2+、NO3-、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com