
【题目】医药阿斯匹林的结构简式如图。试回答:
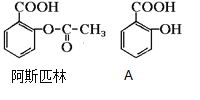
(1)阿斯匹林可看成酯类物质,口服后在胃肠作用下,阿斯匹林发生水解反应,生成A和B两种产物。其中A的结构简式如图,则阿斯匹林的分子式为:____________,B的结构简式为:_______,B中的官能团是:____________(名称)。
(2)上述水解产物B与甲醇、浓硫酸共热反应的化学方程式为:____________。
(3)甲醇在铜作催化剂时与氧气反应的化学方程式为:_______________。
【答案】C9H8O4 CH3COOH 羧基 CH3COOH+CH3OH![]() CH3COOCH3+H2O 2CH3OH+O2
CH3COOCH3+H2O 2CH3OH+O2![]() 2HCHO+2H2O
2HCHO+2H2O
【解析】
(1)由结构可知分子式,由图可知生成A为邻羟基苯甲酸,根据酯水解规律可知B为CH3COOH;
(2)乙酸与甲醇在浓硫酸存在条件下发生酯化反应生成乙酸甲酯;
(3)甲醇在铜作催化剂时与氧气反应生成HCHO。
(1)由结构可知阿斯匹林的分子式为C9H8O4,其中含酯基-COOC-可发生水解反应生成A和B,生成A为邻羟基苯甲酸,则B为CH3COOH,B的官能团为羧基;
(2)阿司匹林水解产生A是邻羟基苯甲酸,B是乙酸,乙酸与甲醇、浓硫酸共热反应的化学方程式为CH3COOH+CH3OH![]() CH3COOCH3+H2O;
CH3COOCH3+H2O;
(3)甲醇分子中羟基连接的C原子上有2个H原子,在铜作催化剂时与氧气发生氧化反应,产生甲醛和水,反应的化学方程式为2CH3OH+O2![]() 2HCHO+2H2O。
2HCHO+2H2O。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】祖母绿被称为绿宝石之王,是国际珠宝世界公认的四大名贵宝石之一,其化学式为Be3Al2Si6O18。回答下列问题:
(1)基态Be原子的电子排布图为____________,基态Al原子核外电子占据________个轨道,其中能量最高能级的原子轨道的形状为__________。
(2)Al、Si、O的第一电离能由大到小的排序为____________________。
(3)SO3分子中硫原子的杂化类型是_____,SO3分子的空间构型是________。
(4)工业上,电解制取金属铝,不能用熔融的AlCl3,AlCl3的晶体类型是__________,将Be3Al2Si6O18写为氧化物的式子是_____________________。
(5)LiAlH4在有机合成中可将羧基还原成羟基。甲酸和乙醇的熔、沸点如图所示:
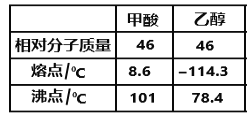
1mol甲酸分子中σ键与π键的比值为________________,甲酸和乙醇的熔点相差较大的主要原因是____________________________________________。
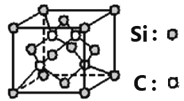
(6)碳化硅的晶体类型类似金刚石,晶胞结构如图所示。已知:碳化硅的晶体密度为ag/cm3,NA代表阿伏伽德罗常数的数值。该晶胞边长为_____________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式为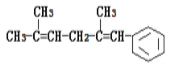 ,判断下列说法中不正确的是( )
,判断下列说法中不正确的是( )
A.它可以使酸性KMnO4溶液褪色
B.它可发生取代反应、加成反应、加聚反应、氧化反应
C.1mol该有机物燃烧消耗氧气为18.5mol
D.它与氢气发生加成反应,最多可以消耗4mol氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)键线式![]() 的系统命名为 __________________;
的系统命名为 __________________;
(2)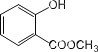 中含有的官能团为_______________;
中含有的官能团为_______________;
(3)2-甲基-1-丁烯的结构简式____________________;
(4)相对分子质量为 72 且一氯代物只有一种的烷烃的结构简式________________;
(5)分子式为 C2H6O 的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是________________;
A.红外光谱 B.核磁共振氢谱 C.质谱法 D.与钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸是天然的酸味调节剂,乳酸的结构简式为![]() ,下列关于乳酸的说法正确的是( )
,下列关于乳酸的说法正确的是( )
A.含有醛基官能团
B.1mol乳酸可以和2molNaOH 溶液恰好完全反应
C.1mol乳酸和碳酸氢钠溶液充分反应生成2molCO2
D.乳酸和乙酸都显酸性,但它们在浓硫酸作用下经加热可以发生化学反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2通入BaCl2溶液无明显现象。某同学利用如图装置探究SO2与BaCl2溶液反应生成白色沉淀的条件。下列判断正确的是
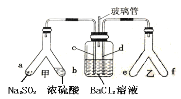
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.乙中产生的一定为氧化性气体,将BaSO3氧化为BaSO4沉淀
C.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
D.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图,该物质应有的化学性质是
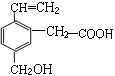
①可燃烧;②可跟溴加成;③可使酸性KMnO4溶液褪色;④可跟NaHCO3溶液反应⑤可跟Cu(OH)2悬浊液反应;⑥可跟金属钠反应
A. ①②③⑥B. ②③④⑥C. ②③④⑤⑥D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
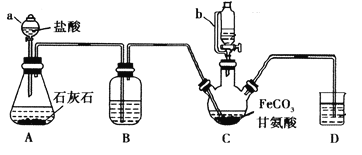
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为: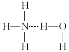
C. NCl3分子是非极性分子
D. NBr3比NCl3易挥发
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com