
| 实验步骤 | 现象和结论 |
| 步骤1:取少量吸收液于试管,滴加稀硫酸酸化,然后再滴入几滴 品红 品红 溶液. |
现象: 品红不褪色 品红不褪色 结论:假设1不成立. |
| 步骤2: 另取少量吸收液于试管中, 另取少量吸收液于试管中, 滴入几滴KSCN溶液 滴入几滴KSCN溶液 . |
现象: 溶液变红 溶液变红 结论:假设2成立. |
| 实验步骤 | 现象和结论 |
| 品红 | 品红不褪色 |
| 步骤2:另取少量吸收液于试管中,滴入几滴KSCN溶液 | 溶液变红 |
| 2 |
| 10 |
| 5 |
| 2 |
| 8×10-3g |
| 500L |


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
(2013?马鞍山一模)可逆反应2SO2(g)+O2(g)?2SO3(g),根据下表中的数据判断下列图象错误的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
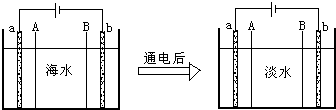
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com