
| A. | 钢是铁的一种合金 | |
| B. | 通常合金的硬度比不上纯净的金属 | |
| C. | 合金是两种金属熔合而成的具有金属特性的物质 | |
| D. | 一般地说合金的熔点比它的各成分金属的熔点都高 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4分子的比例模型: | B. | 氯原子的结构示意图: | ||
| C. | NH3分子的电子式: | D. | CO2分子的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
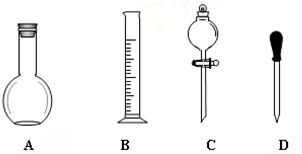 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有两研究性学习小组拟探究卤代烃的性质.查资料得知:溴乙烷的沸点为3.4℃,乙醇的沸点℃.
有两研究性学习小组拟探究卤代烃的性质.查资料得知:溴乙烷的沸点为3.4℃,乙醇的沸点℃.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,指出该化合物中的化学键离子键、非极性共价键.
,指出该化合物中的化学键离子键、非极性共价键. (6)请写出元素G的基态原子电子排布式1s22s22p63s23p63d54s1.在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(6)请写出元素G的基态原子电子排布式1s22s22p63s23p63d54s1.在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{1000{ρ_1}{ρ_2}ω}}{{{ρ_1}+4}}$mol/L | B. | $\frac{{1000{ρ_1}{ρ_2}ω}}{{36.5({ρ_1}+4)}}$mol/L | ||
| C. | $\frac{{1000{ρ_1}}}{182.5}$mol/L | D. | $\frac{{1000{ρ_1}{ρ_2}ω}}{182.5}$mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com