
| A. | 氢有三种核素:H、D、T | B. | S2-的结构示意图: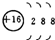 | ||
| C. | 石英中存在SiO2分子 | D. | CO2分子的结构式:O=C=O |
分析 A.氢有三种原子,分别为氕、氘和氚;
B.硫离子的核电荷数为16,核外电子总数为18,最外层达到8电子稳定结构;
C.二氧化硅为由原子构成的原子晶体;
D.二氧化碳分子中存在两个碳氧双键,用短线表示共用电子对即为结构式.
解答 解:A.氢有三种原子,分别为氕、氘和氚,原子符号为H、D、T,故A正确;
B.S2-的核电荷数为16,核外电子总数为18,硫离子结构示意图为: ,故B正确;
,故B正确;
C.二氧化硅为由原子构成的原子晶体,不存在分子,故C错误;
D.CO2分子为直线型结构,分子中存在两个碳氧双键,二氧化碳的结构式为:O=C=O,故D正确;故选C.
点评 本题考查了核素、离子结构示意图、结构式、晶体类型的判断,题目难度中等,注意掌握常见化学用语的概念及表示方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
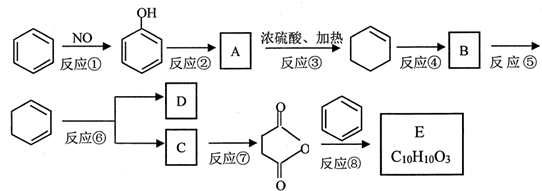
 +(CH3CO)2O→
+(CH3CO)2O→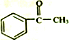 +CH3COOH
+CH3COOH ;B
;B .
. 直接制取
直接制取 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.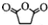 +
+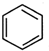 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$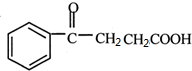 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
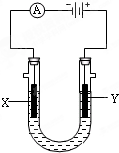 电解原理在化学工业中有广泛应用.
电解原理在化学工业中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入甲基橙试液显红色的溶液:Mg2+、Al3+、Br-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液中:Na+、NH4+、ClO-、I- | |
| C. | 0.1mol/LNaHCO3溶液中:K+、Ba2+、OH-、Cl- | |
| D. | 加入铝粉放出大量H2的溶液中:Fe2+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
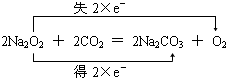 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙 | |
| B. | 对苯二甲酸(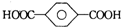 ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (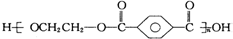 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. | 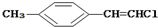 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
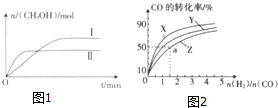 在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2,3mol H2 | 2mol CO2,6mol H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com