
 .
.分析 I.(1)计算CO2和H2O的物质的量,再计算n(C)、n(H),根据质量守恒计算有机物中氧元素质量,进而计算n(O),根据C、H、O原子数目之比确定柠檬酸的实验式;
(2)由相对分子质量,结合实验式确定分子式;
(3)利用红外光谱分析确定含有的官能团或基团;
(4)核磁共振氢谱分析发现有4个吸收峰,说明柠檬酸分子中有4中化学环境不同的H原子,峰面积之比等于H原子数目之比,结合有机物分子式与含有的官能团确定结构简式;
Ⅱ.(4)根据柠檬酸的相对分子量及生成酯类物质的相对分子量确定A的分子量,然后判断A可能的结构简式.
解答 解:(1)n(CO2)=$\frac{26.4g}{44g/mol}$=0.6mol,则n(C)=0.6mol,m(C)=0.6mol×12g/mol=7.2g,
n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,则n(H)=0.8mol,m(H)=0.8mol×1g/mol=0.8g,
根据质量守恒可知,柠檬酸中氧原子质量为:m(O)=19.2g-7.2g-0.8g=11.2g,则n(O)=$\frac{11.2g}{16g/mol}$=0.7mol,
则柠檬酸分子中n(C):n(H):n(O)=0.6mol:0.8mol:0.7mol=6:8:7,
故柠檬酸酸的实验式为C6H8O7,
故答案为:C6H8O7;
(2)柠檬酸的相对分子质量为192,实验式为C6H8O7,实验式的相对分子质量为192,故实验式为柠檬酸的分子式,
故答案为:C6H8O7;
(3)利用红外光谱分析NB酸分子中含有-COOH和-OH,
胡答案为:红外光谱;
(4)柠檬酸分子式为C6H8O7,不饱和度=$\frac{6×2+2-8}{2}$=3,红外光谱分析柠檬酸分子中含有-COOH和-OH,则分子中含有3个-COOH和1个-OH,剩余碳链有3个碳原子,分子中有4种化学环境不同的H原子,H原子数目分别为4、2、1、1,其分子中不含甲基,其中2个-COOH处于相同化学环境,故含有2个CH2且化学环境相同,另外的-COOH与-OH,连接同中间碳原子上,故柠檬酸的结构为 ,
,
故答案为: ;
;
(4)柠檬酸的相对分子量为192,与有机物A在一定条件下发生酯化反应可生成一种相对分子质量为220的酯类物质,酯的分子量增加了:220-192=28,只能形成1个酯基,则A的相对分子量为:220+18-192=46,
柠檬酸中含有官能团羧基和羟基,则A可能为羧酸或醇类,若A为醇,分子量为46的醇为乙醇,结构简式为:CH3CH2OH,若A为羧酸,相对分子量为46的羧酸为甲酸,其结构简式为:HCOOH,
故答案为:CH3CH2OH或HCOOH.
点评 本题考查有机物分子式与结构简式的确定,题目难度中等,注意掌握确定有机物分子式方法,(3)中结构简式的书写为易错点、难点,注意根据红外光谱可知不含碳碳不饱和键.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀盐酸与0.1 mol•L-1 KOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=+57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、NH3、CH4 | B. | H2SO4、HNO3、BaCl2 | ||
| C. | CO2、NH3、Cu | D. | KNO3、NaOH、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | e=$\frac{1}{11.2}$mol•L-1、ω=$\frac{36.5}{224ρ}$% | B. | e=$\frac{1}{22.4}$mol•L-1、ω=$\frac{36.5}{224ρ}$% | ||
| C. | e=$\frac{1}{22.4}$mol•L-1、ω=$\frac{36.5}{112ρ}$% | D. | e=$\frac{1}{11.2}$mol•L-1、ω=$\frac{23}{224}$% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
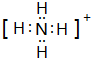 ,E分子的空间构型为三角锥形.
,E分子的空间构型为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 操作 | 解释 | |
| A | 去除二氧化硫中的混有的二氧化碳 | 氯化钡溶液洗气 | 二氧化碳能与氯化钡溶液反应 |
| B | 提纯含氯化铁杂质的氯化钠 | 重结晶 | 氯化铁和氯化钠的溶解度随温度变化差异大 |
| C | 分离乙酸和乙酸乙酯的混合物 | 萃取 | 乙酸和乙酸乙酯的混合物静置分层 |
| D | 分离乙醇和水的混合物 | 蒸馏 | 两者互溶且沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④ | C. | ①②④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸均能与Na反应放出氢气,二者分子中官能团相同 | |
| B. | 苯和油脂均不能使酸性KMnO4溶液褪色 | |
| C. | 蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体 | |
| D. | 纤维素和淀粉遇碘水均显蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com