
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为1.5NA | |
| C. | 12 g金刚石中含有C-C键的个数为4NA | |
| D. | SiO2晶体中存在四面体结构单元,O处于中心,Si处于4个顶角 |
分析 通过n=$\frac{m}{M}$计算各物质的物质的量,结合各晶体的结构确定各个化学键的个数.
解答 解:A、n(P4)=$\frac{m}{M}$=$\frac{124g}{124g/mol}$=1mol,1个P4分子含有6个P-P键,因此124g P4含有的P-P键的物质的量为6mol,P-P键的个数为6NA,故A错误;
B、12g石墨中含有碳原子的物质的量n=$\frac{m}{M}$=$\frac{12g}{12g/mol}$=1mol,在石墨晶体中一个碳原子形成3个C-C键,每个C-C键由2个碳原子构成,因此12g石墨中含有C-C键的物质的量为1mol×3×$\frac{1}{2}$=1.5mol,C-C键的个数为1.5NA,故B正确;
C、12g金刚石中含有碳原子的物质的量n=$\frac{m}{M}$=$\frac{12g}{12g/mol}$=1mol,在金刚石晶体中每个碳原子形成4个C-C键,每个C-C键由2个碳原子构成,因此12g金刚石中含有C-C键的物质的量为1mol×4×$\frac{1}{2}$=2mol,C-C键的个数为2NA,故C错误;
D、二氧化硅晶体中存在四面体结构单元,每个硅原子能构成四个共价键,每个氧原子能形成2个共价键,Si处于中心,O处于4个顶角,故D错误,故选B.
点评 本题考查阿伏伽德罗常数的有关计算,难度中等,侧重于分子晶体、原子晶体、混合晶体结构的考查,掌握物质的晶体结构是解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
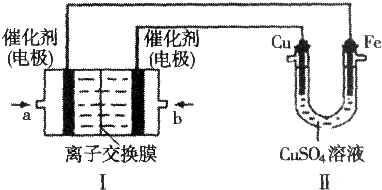
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+CH4$→_{△}^{催化剂}$CH3COOH | |
| B. | 2CO2+6H2$→_{△}^{催化剂}$C2H5OH十3H2O | |
| C. | 2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O | |
| D. | 6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
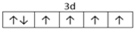 ,
,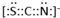 .F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为12×6.02×1023个或12NA
.F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为12×6.02×1023个或12NA查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸、氯水保存在棕色试剂瓶中 | |
| B. | 漂白粉长期放置在烧杯中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 少量的金属钠存放于煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 氯化铝与足量氨水反应:Al3++3NH3•H2O═3NH4++Al(OH)3↓ | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 稀硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(HRO3-)+c(RO32-)+c(OH-)=c(H+)+c(Na+) | |
| C. | c(Na+)=c(HRO3-)+c(H2RO3)+c(RO32-) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
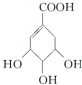 (提示:环丁烷
(提示:环丁烷 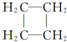 可简写成
可简写成  )
)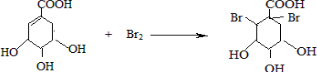
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com