
【题目】一种新型漂白剂(如下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述正确的是( )
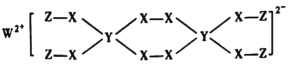
A.少量W单质保存在煤油中
B.W、X、Y对应原子半径顺序为:W>X>Y
C.该漂白剂中各元素均满足8电子稳定结构
D.Y的最高价氧化物对应水化物的化学式为![]()
【答案】D
【解析】
W、Y、Z为不同周期不同主族的短周期元素,说明有一种元素为H,根据图示结构可知,W形成+2价阳离子,X形成2个共价键,Y可以形成4个单键,Z形成1个共价键,则Z为H元素,W位于ⅡA族,X位于ⅥA族;W、X对应的简单离子核外电子排布相同,则W为Mg,X为O元素;W、Y、Z的最外层电子数之和等于X的最外层电子数,Y的最外层电子数为6-2-1=3,Y位于ⅢA族Y与H、Mg不同周期,则Y为B元素。
A.Mg的表面能形成一层致密的氧化膜,少量Mg单质不需保存在煤油中,故A错误;
B.Mg原子核外有3层电子,O和B原子核外有2层电子,但B的核电荷数较小,半径较大,所以对应原子半径大小顺序为Mg>B>O,即W>Y>X,故B错误;
C.该漂白剂中H元素不满足8电子稳定结构,故C错误;
D.Y为B元素,B的最高价氧化物对应水化物化学式为H3BO3,故D正确;
故答案为D。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,由一氧化碳和二氧化碳组成的混合气体为6.72 L,质量为12g,此混合物中一氧化碳和二氧化碳物质的量之比是__________,一氧化碳的体积分数是__________,一氧化碳的质量分数是__________,碳原子和氧原子个数比是__________,混合气体的平均相对分子质量是__________,密度是__________g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

ΔH=88.6 kJ/mol则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热为-726.5 kJ·mol-1,CH3OH(l)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:_______________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、科技及环境密切相关。下列说法正确的是( )
A.2020年3月9日,发射了北斗系统第五十四颗导航卫星,其计算机的芯片材料是一种有机高分子材料
B.白葡萄酒含维生素C等多种维生素,通常添加微量![]() 的目的是防止营养成分被氧化
的目的是防止营养成分被氧化
C.酒精与84消毒液混合,可增强杀灭新型冠状病毒效果
D.聚合硫酸铁![]() ,是新型絮凝剂,可用来杀灭水中病菌
,是新型絮凝剂,可用来杀灭水中病菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,干燥的烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是( )

A.二氧化碳(碳酸氢钠溶液)—无色喷泉
B.氨气(水含有酚酞)—红色喷泉
C.硫化氢(硫酸铜溶液)—黑色喷泉
D.氯化氢(硝酸银溶液)—白色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是( )
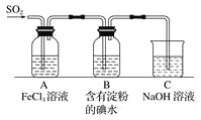
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年2月27日至3月1日,第十届日本国际二次电池展在日本东京举行,各种新型二次电池在东京有明展览中心展出,其中以![]() 为代表的新型可充电钠离子电池,格外引人注意,其放电工作原理如图所示。下列说法正确的是( )
为代表的新型可充电钠离子电池,格外引人注意,其放电工作原理如图所示。下列说法正确的是( )

A.放电时,正极反应式为:![]()
B.放电时,电子自Mg箔流出,经含Na+的电解质流向Mo箔
C.充电时,Na+通过离子交换膜从右室移向左室
D.充电时,Mo箔接电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、S、P等元素常用于化工材料的合成。回答下列问题:
、S、P等元素常用于化工材料的合成。回答下列问题:
(1)钴原子的基态电子排布式为_______________________。
(2)![]() 有________几种不同的运动状态的电子,
有________几种不同的运动状态的电子,![]() 比
比![]() 更稳定的原因是_________。
更稳定的原因是_________。
(3)硒为第四周期元素,相邻元素有砷和溴,则三种元素的电负性从大到小的顺序为_________(用元素符号表示)。
(4)![]() 的熔点为340℃,加热易升华,固体
的熔点为340℃,加热易升华,固体![]() 属于______晶体。
属于______晶体。![]() 的空间构型为_____。
的空间构型为_____。
(5) ![]() 可用于制造火柴,其分子结构如图甲所示。
可用于制造火柴,其分子结构如图甲所示。![]() 分子中S的杂化方式为______。每个
分子中S的杂化方式为______。每个![]() 分子中含有的孤电子对的数目为_________。
分子中含有的孤电子对的数目为_________。


(6)铜的某种氧化物晶胞结构如图乙所示,该氧化物的化学式为____________。若该晶胞的边长为![]() ,阿伏加德罗常数值为
,阿伏加德罗常数值为![]() ,则该氧化物的密度为_________
,则该氧化物的密度为_________![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是
4NO+6H2O,对于该反应判断正确的是
A. 氧气被还原B. 该反应是置换反应
C. 氨气是氧化剂D. 若有17 g氨参加反应,反应中转移10 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com