
分析 (1)亚铁离子具有还原性,与氯气发生氧化还原反应;
(2)盐酸溶液中的氢离子与活泼的金属单质;
(3)阴离子硝酸根离子在酸性条件下具有氧化性,氧化还原的亚铁离子;
(4)次氯酸根离子与氯离子在酸性条件下发生氧化还原反应.
解答 解:(1)亚铁离子具有还原性,与氯气发生氧化还原反应,离子反应方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(2)盐酸溶液中的氢离子与活泼的金属单质,离子反应方程式为:Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(3)阴离子硝酸根离子在酸性条件下具有氧化性,氧化还原的亚铁离子,离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)次氯酸根离子与氯离子在酸性条件下发生氧化还原反应,离子反应方程式为:Cl-+ClO-+2H+=Cl2↑+H2O,故答案为:Cl-+ClO-+2H+=Cl2↑+H2O.
点评 本题考查氧化还原反应,为高频考点,侧重分析与应用能力的考查,题目难度不大.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:解答题
| 阳离子 | Cu2+、Fe3+、Al3+、K+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、SO42-、Ba2+ | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、HCO3-、Ca2+、Na+ | D. | Ba2+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极附近溶液的碱性增强 | |
| B. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| C. | 放电时正极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 该原电池,Zn作正极,可用石墨等作负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
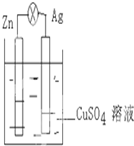 如图,在银锌原电池中,以硫酸铜溶液为电解质溶液.
如图,在银锌原电池中,以硫酸铜溶液为电解质溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极附近的 SO42-离子浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 溶液的pH逐渐变小 | |
| D. | 铜片上有H2逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +HO-SO3H$\stackrel{70℃~80℃}{→}$
+HO-SO3H$\stackrel{70℃~80℃}{→}$ +H2O,该反应属于( )
+H2O,该反应属于( )| A. | 置换反应 | B. | 中和反应 | C. | 复分解反应 | D. | 取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
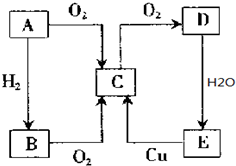 A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体单质,C气体能够使品红溶液褪色.
A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体单质,C气体能够使品红溶液褪色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com