
| A. | SO2 | B. | NO2 | C. | CO2 | D. | NH3 |
科目:高中化学 来源: 题型:选择题
| A. | 加水溶解,用红色石蕊试纸测其溶液的酸碱性 | |
| B. | 加强碱溶液后加热,滴入酚酞试液,观察溶液颜色 | |
| C. | 加热,将湿润的红色石蕊试纸放在管口观察现象 | |
| D. | 加苛性钠溶液后加热,用湿润的红色石蕊试纸放在试管口进行检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| B. | 化学能与其他形式的能相互转化的途径是化学反应 | |
| C. | 乙醇分子与水分子之间不仅存在范德华力还存在氢键 | |
| D. | 微粒半径K+<Cl?<S2? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
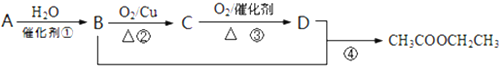
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
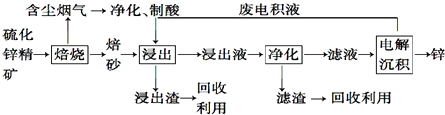
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
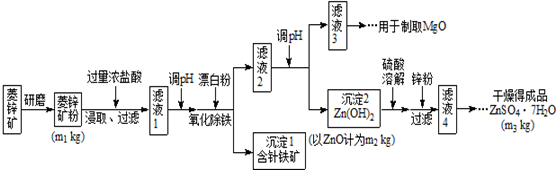
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
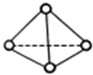 科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断裂1mol键N≡N吸收946kJ热量,则下列叙述中正确的是( )
科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断裂1mol键N≡N吸收946kJ热量,则下列叙述中正确的是( )| A. | 1molN4气体转化为N2时要吸收206 kJ能量 | |
| B. | N4是一种比N2更稳定的分子 | |
| C. | 1molN4气体转化为N2时要放出740 kJ能量 | |
| D. | N4与N2之间不是同素异形体关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 熔沸点由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 沸点由高到低:HI>HBr>HCl>HF | |
| D. | 硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为MgB2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com