
分析 (1)①25℃时,0.1mol•L-1的某酸HA中,如果该酸是强酸c(H+)=0.1mol•L-1,若是弱酸,弱酸溶液中存在电离平衡,溶液中c(H+)<0.1mol•L-1;
②NaA溶液是强碱弱酸盐,溶液中A-离子水解显碱性;
(2)常温下,水的离子积为1×10-14,c(H+)=10-7mol/L,由水电离产生的c(H+)等于10-10mol/L,纯水的离子积为1×10-20,说明该溶液中的溶质抑制了水的电离,该溶液为酸或者碱溶液,据此进行判断;
(3)先判断出酸和碱混合后溶液NaOH过量,溶液显碱性,根据c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$求出氢氧根的浓度,然后根据水的离子积求出c(H+),即可求出溶液的pH;
(4)根据NH4Cl溶液呈酸性可知,要使混合后呈中性,必须氢氧化钠过量;根据电荷守恒来分析;
(5)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,反应后一水合氨又电离出氢氧根离子,溶液呈碱性;
(6)氯化铝水溶液呈酸性是因为铝离子水解显酸性;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是水解生成的氢氧化铝分解得到的氧化铝;
(7)难溶电解质的溶度积越小,加入氨水时越易生成沉淀.
解答 解:(1)①25℃时,0.1mol•L-1的某酸HA中,如果该酸是强酸c(H+)=0.1mol•L-1,若是弱酸,弱酸溶液中存在电离平衡,溶液中c(H+)<0.1mol•L-1,
25℃时,0.1mol/L的HA溶液中c(H+)=10-2mol/L,氢离子未全部电离出来,说明HA为弱酸,
故答案为:弱酸;
②NaA溶液是强碱弱酸盐,溶液中A-离子水解显碱性,反应的离子方程式为:A-+H2O?HA+OH-,
故答案为:碱性,A-+H2O?HA+OH-;
(2)常温下,水的离子积为1×10-14,c(H+)=10-7mol/L,由水电离产生的c(H+)等于10-10mol/L,纯水的离子积为1×10-20,说明该溶液中的溶质抑制了水的电离,该溶液为酸或者碱溶液,
A.pH=4的醋酸溶液电离出的氢离子抑制水的电离,故A正确;
B.pH=10的NaOH溶液中电离出的氢氧根离子抑制水的电离,故B正确;
C.pH=9的Na2CO3溶液中碳酸根离子水解,溶液显碱性,促进了水的电离,故C错误;
D.pH=4的NH4Cl溶液中铵根离子水解,溶液显酸性,促进了水的电离,故D错误;
故选AB.
(3)该温度下,将100mL 0.1mol•L-1的稀H2SO4中n(H+)=CV=0.2mol/L×0.1L=0.02mol,100mL 0.4mol•L-1的NaOH溶液中n(OH-)=CV=0.4mol/L×0.1L=0.04mol,混合后,NaOH过量,溶液显碱性,溶液中c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$=$\frac{0.04mol-0.02mol}{0.2L}$=0.1mol/L,由于水的离子积Kw=c(H+)•c(OH-)=10-12,c(H+)=$\frac{1{0}^{-12}}{0.1}$mol/L=10-11mol/L,PH=11,
故答案为:11;
(4)根据NH4Cl溶液呈酸性可知,要使混合后呈中性,必须氢氧化钠过量;根据电荷守恒来分析,a<b,
故答案为:<;
(5)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,反应后一水合氨又电离出氢氧根离子,溶液呈碱性,溶液中电荷守恒分析,离子浓度的关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(6)氯化铝水溶液呈酸性是因为铝离子水解显酸性,Al3++3H2O?Al(OH)3+3H+,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是水解生成的氢氧化铝分解得到的氧化铝,
故答案为:Al3++3H2O?Al(OH)3+3H+,Al2O3;
(7)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;
点评 本题考查了酸碱反应后溶液酸碱性分析判断,离子浓度大小比较,盐类水解,溶度积常数的计算分析,影响水电离的因素分析判断,掌握基础是关键,题目难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:解答题
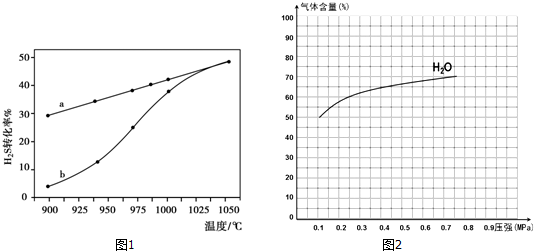
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: Ⅰ:C(s)+H2O(g)═CO(g)+H2(g) K1 Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)K2 Ⅲ:CaO(s)+CO2(g)═CaCO3(s)K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)═CO2(g) △H=-393.8kJ•mol-1 V:CaCO3(s)═CaO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大、增大、不变、减小 | B. | 减小、增大、不变、减小 | ||
| C. | 增大、减小、减小、减小 | D. | 增大、减小、减小、增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

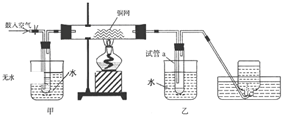
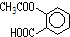 ,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 使用该漂白剂的最佳pH为3 | |
| B. | pH=5时,溶液中$\frac{c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$═$\frac{1}{10}$ | |
| C. | pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c( ClO2-)>c( ClO2)>c( Cl-) | |
| D. | NaClO2溶液加水稀释所有离子浓度均减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com