
【题目】学生利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)

回答下列问题:
(1)所用铁粉中若有杂质,欲除去不纯铁粉中混有的铝粉可以选用的试剂为_____________(填序号)。
A.稀盐酸 B.氢氧化钠溶液 C.浓硫酸 D.FeCl3溶液
此步涉及反应的离子方程式为_____________________________________。
(2)反应发生后装置B中发生反应的化学方程式是______________________________。D装置的作用:________________________________________________。
(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
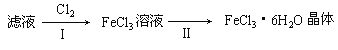
①用离子方程式表示步骤I中通入Cl2的作用__________________________________;
②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明。向一支装有该未 知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液。你认为此方案是否合理_______________(填“合理”或“不合理”)。
【答案】B 2Al+2OH-+2H2O=2![]() +3H2↑ 3Fe + 4H2O
+3H2↑ 3Fe + 4H2O![]() Fe3O4+ 4H2 除去H2中的水蒸气 Cl2+ 2Fe2+=2Fe3++2Cl- 不合理
Fe3O4+ 4H2 除去H2中的水蒸气 Cl2+ 2Fe2+=2Fe3++2Cl- 不合理
【解析】
(1)A.Fe、Al都能溶于稀盐酸,不能用稀盐酸除去铁粉中的铝粉;
B.Fe与NaOH溶液不反应,Al溶于NaOH溶液生成偏铝酸钠溶液,可选用NaOH溶液除去铁粉中的铝粉;
C.常温下,Fe、铝与浓硫酸都发生钝化,不能用浓硫酸除去铁粉中混有的铝粉;
D.Fe、Al都能溶于FeCl3溶液,不能用FeCl3溶液除去铁粉中的铝粉;
答案选B;
该反应的离子方程式是2Al+2OH-+2H2O=2![]() +3H2↑;
+3H2↑;
(2)装置B中Fe与水蒸气发生反应的化学方程式是3Fe + 4H2O(g)![]() Fe3O4+ 4H2;D装置的作用干燥氢气(或除去氢气中的水蒸气);
Fe3O4+ 4H2;D装置的作用干燥氢气(或除去氢气中的水蒸气);
(3)① Fe3O4与盐酸发生反应:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,因此滤液中含有FeCl3和FeCl2,向其中通入氯气,发生反应:Cl2+ 2Fe2+=2Fe3++2Cl-;然后将溶液蒸发浓缩,冷却结晶就得到FeCl3·6H2O。
②由于Fe3++3SCN-=Fe(SCN)3,溶液是红色的,即使原来的溶液完全是Fe3+,同样会发生上述现象,因此此方案不合理。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种副作用小的新型镇痛消炎药K的合成路线如图所示:
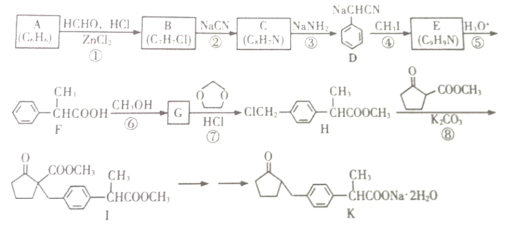
请回答下列问题
(1)F分子中官能团的名称为______________;B分子中处于同一平面的原子最多有____个
(2)反应⑥的条件为_______________;反应⑧的类型为_______________________。
(3)反应⑦除生成H外,另生成一种有机物的结构简式为_______________________。
(4)反应①的化学方程式为_______________________。
(5)符合下列条件的G的同分异构体有_____________种
Ⅰ.苯环上有且仅有四个取代基;
Ⅱ.苯环上的一氯代物只有一种;
Ⅲ.能发生银镜反应。
其中还能发生水解反应的同分异构体的结构简式为______________(只写一种即可)。
(6)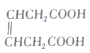 是合成
是合成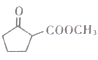 的重要中间体。参照题中合成路线,设计由1,3-丁二烯合成
的重要中间体。参照题中合成路线,设计由1,3-丁二烯合成![]() 的一种合成路线(无机试剂任选):_______________。
的一种合成路线(无机试剂任选):_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气的用途非常广泛。实验室用如下装置制取氯气,并用制取氯气进行性质探究实验。回答下列问题:
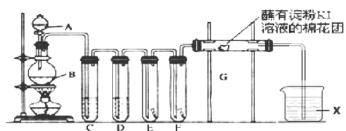
(1)A中盛有浓盐酸,B中盛有![]() ,写出反应的离子方程式__________________。
,写出反应的离子方程式__________________。
(2)E中为红色干布条,F中为红色湿布条,对比E和F中观察现象的差异可得出的结论是__________________。
(3)试管C和D中试剂名称各为_____________________。X试剂的作用是______________。
(4)装置G处发生反应的离子方程式为_____________________________。
(5)家庭中常用消毒液(主要成分![]() )与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒氯气,写出反应的离子方程式____________。
②需“密闭保存”的原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为( )
A.-488.3kJ·mol-1
B.-191kJ·mol-1
C.-476.8kJ·mol-1
D.-1549.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出相关的反应方程式:
(1)由可溶性铝盐制取氢氧化铝,需加入的试剂为:________;反应方程式为:_____________。
(2)白色的Fe(OH)2在空气中发生的颜色变化为___________。反应的化学方程式为:________。
(3)氯气与铁反应:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下均能通过一步反应实现的是
A. NaAlO2(aq)![]() AlCl3
AlCl3![]() Al2O3
Al2O3
B. N2![]() NO2
NO2![]() HNO3
HNO3
C. NaCl(饱和)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
D. FeS2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础](15分)聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。 PPG的一种合成路线如下:
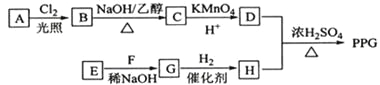
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④![]() 。
。
回答下列问题:
(1)A的结构简式为 。
(2)由B生成C的化学方程式为 。
(3)由E和F生成G的反应类型为 ,G的化学名称为 。
(4)①由D和H生成PPG的化学方程式为 。
②若PPG平均相对分子质量为10000,则其平均聚合度约为 (填标号)。
a.48 b.58 c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 (写结构简式):
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组根据反应 H2O2+2HI=2H2O+I2 探究影响化学反应速率的因素。实验数据如下
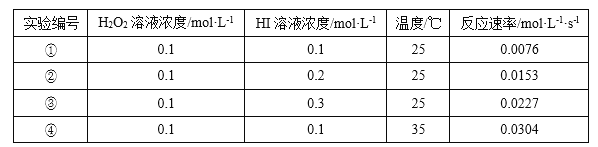
回答下列问题:
(1)反应 H2O2+2HI=2H2O+I2 中,氧化剂是_____。
(2)25℃时,表明增大反应物浓度,化学反应速率_____(填“增大”成“减小”)。
(3)能表明温度对化学反应速率影响的实验编号是①和_____。
(4)H2O2 不稳定,写出 H2O2 发生分解反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A、B、C分别是三种有机物的结构模型:
A B
B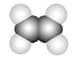 C
C
请回答下列问题:
(1)A、B两种模型分别是有机物的________模型和________模型。
(2)A及其同系物的分子式符合通式________(用n表示)。当n=________时,烷烃开始出现同分异构体。
(3)A、B、C三种有机物中,所有原子均共面的是________(填名称)。
(4)有机物C具有的结构或性质是________(填字母序号)。
a .是碳碳双键和碳碳单键交替的结构 b. 有毒、不溶于水、密度比水小
c. 不能使酸性KMnO4溶液和溴水褪色 d. 一定条件下能与氢气或氧气反应
(5)等质量的三种有机物完全燃烧生成H2O和CO2,消耗氧气的体积(相同状况下)最大的是________(填分子式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com