
【题目】按如图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是( )
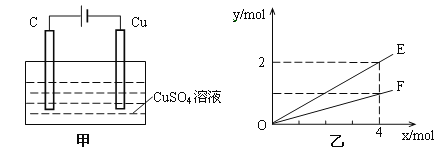
A. E表示生成铜的物质的量
B. E表示反应消耗水的物质的量
C. F表示反应生成氧气的物质的量
D. F表示生成硫酸的物质的量
【答案】D
【解析】分析:由甲可知,该装置为电解池,C为电解池的阳极,电极反应式为4OH--4e-=O2↑+2H2O,Cu为电解池的阴极,电极反应式为Cu2++2e-=Cu,总反应为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,结合乙可知,转移4mol电子生成(或消耗)2molE,生成(或消耗)1molF,据此解答。
2Cu+O2↑+2H2SO4,结合乙可知,转移4mol电子生成(或消耗)2molE,生成(或消耗)1molF,据此解答。
详解:A、由电子与生成物的物质的量的关系可知E表示反应生成铜的物质的量,A正确;
B、由总反应结合电子与生成物的物质的量的关系可知,则E表示消耗水的物质的量,B正确;
C、由电子与生成物的物质的量的关系可知F表示反应生成氧气的物质的量,C正确;
D、由总反应结合电子与反应物的物质的量的关系可知,F不能表示反应生成硫酸的物质的量,D错误;答案选D。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.SF6是一种优良的绝缘气体,分子结构中,只存在S—F键,已知1 mol S(s)转化为气态硫原子吸收能量280 kJ,F—F键能为160 kJ·mol-1,S—F键能为330 kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式_______________________________。
Ⅱ.V、W、X、Y、Z是由四种短周期元素中的2种或3种组成的5种化合物,其中W、X、Z均由2种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素A和两种非金属元素B与C组成,其化学式构成为A(BC3)3 。它们之间的反应关系如下图:

(1)写出物质W的一种用途:__________________________________________________。
(2)写出V与足量NaOH溶液反应的化学方程式:________________________________。
(3)将少量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为________________________________________________________________________。
(4)写出气体X的结构式__________。
(5)以Z为燃料,活性炭为电极,熔融碳酸盐(如熔融K2CO3)环境下制成燃料电池的负极反应式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图象的叙述,正确的是( ) 
A.甲图表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJmol﹣1
B.乙图表示恒温恒容条件下发生的可逆反应2NO2(g)N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙图表示
A.B两物质的溶解度随温度变化情况,将A,B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数仍为A%=B%D.丁图表示常温下,稀释HA,HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关焰色反应的表述正确的是
A.焰色反应是离子的特有性质
B.焰色反应是单质的特有性质
C.焰色反应是元素的特有性质
D.焰色反应是化合物的特有性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 氯气溶于水:Cl2 + H2O ![]() 2 H
2 H![]() + Cl
+ Cl![]() + ClO
+ ClO![]()
B. NH4HSO4溶液呈酸性的主要原因是:NH4++ H2O ![]() NH3·H2O+ H+
NH3·H2O+ H+
C. 酸性溶液中KIO3与KI反应生成I2:IO![]() + I
+ I![]() + 6 H
+ 6 H![]() = I2 + 3 H2O
= I2 + 3 H2O
D. NaHCO3溶液中加足量Ba(OH)2溶液:HCO![]() + Ba
+ Ba![]() + OH
+ OH![]() = BaCO3↓+ H2O
= BaCO3↓+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两电池电极材料都是铁棒与碳棒,请回答下列问题:

(1)若两电池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒.(填“Fe”或“C”)
②乙池中的阳极反应式为:________________.
③乙池中总反应的化学方程式为:________________.
(2)若两池中均为饱和NaCl溶液,溶液中滴两滴酚酞.
①乙池中总的离子方程式为:________________.
②甲池C极上的电极反应式为:________________.
③甲池中首先出现红色的是_____极;乙池中首先出现红色的是______极(填“Fe”或“C”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d、e的原子序数依次增大,b是地壳中含量最高的元素,e的单质的熔点在同周期元素中最高,a、b的原子序数之和等于e的原子序数,d原子的核外电子层数等于最外层电子数:分别向cdb2溶液、c2eb3溶液中通入气体ab2,产生沉淀的质量与通入气体的体积的定性关系都可用右图表示。下列说法不正确的是
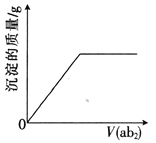
A. 原子半径:c>d>e>a>b
B. 工业上通常采用ab高温还原d2b3的方法冶炼d的单质
C. 同温下,0.1mol·L-1c2eb3溶液的pH大于0.1mol·L-1c2ab3溶液
D. 简单氢化物的热稳定性:b>a>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中. 
请回答下列问题:
(1)H的化学式为 .
(2)D 的电子式为 .
(3)K出反应①的化学方程式: .
(4)写出G的水溶液与C的硝酸盐溶液反应的方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com