
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
分析 (1)①根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积回答;
②已知CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=2.8kJ•mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1 ③
根据盖斯定律,由①+②×2-③×2得CO2(g)+CH4(g)?2CO(g)+2H2(g)△,据此计算;
(2)①依据表中数据分析,随温度升高,平衡常数减小,说明平衡逆向进行;
②计算浓度商和平衡常数比较分析判断反应进行方向;
③化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断.
解答 解:(1)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则CO2(g)+CH4(g)?2CO(g)+2H2(g)的平衡常数表达式为K=$\frac{c(CO)^{2}×c({H}_{2})^{2}}{c(C{O}_{2})×c(C{H}_{4})}$;
故答案为:$\frac{c(CO)^{2}×c({H}_{2})^{2}}{c(C{O}_{2})×c(C{H}_{4})}$;
②已知CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=2.8kJ•mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=-890.3kJ•mol-1+2.8kJ•mol-1×2+566.0kJ•mol-1×2=+247.3 kJ•mol-1,
故答案为:+247.3 kJ•mol-1;
(2)①依据表中数据分析,随温度升高,平衡常数减小,说明平衡逆向进行正反应为放热反应,△H<0;
故答案为:<;
②在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,CO(g)+2H2(g)?CH3OH(g),浓度商Q=$\frac{2}{2×{3}^{2}}$=$\frac{1}{9}$<K=0.270,反应正向进行;
故答案为:A;
③A.容器体积不变,气体质量不变,密度始终不变,所以密度不变不能作为反应达到平衡状态的标志,故A错误;
B.无论是否平衡,均存在v(CO):v(H2):v(CH3OH)=1:2:1,无法判断正逆反应速率是否相等,故B错误;
C.达到平衡时,各反应物的浓度保持不变,所以达平衡时,CH3OH浓度不再变化,故C正确;
D.单位时间内生产nmolCO同时生成2nmolH2,均为逆反应速率,不能判断正逆反应速率是否相等,所以不能说明反应达到平衡状态,故D错误;
故答案为:C.
点评 本题主要考查了化学反应平衡常数表达式、反应的热效应、化学反应进行的方向、化学平衡状态的判断等,根据浓度商和平衡常数的大小来判断反应的进行方向是关键,题目难度中等.


 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |

| A. | 该电池的正极反应式为MnO2+eˉ+H+═MnOOH | |
| B. | 利用干电池,高温电解H2O-CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1 | |
| C. | 废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离 | |
| D. | 废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
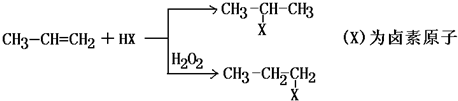

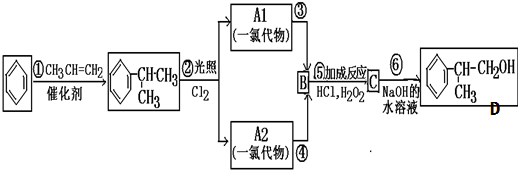
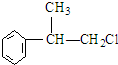 ,
,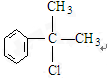
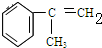 C的结构简式:
C的结构简式: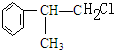 .
.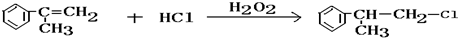 .
.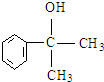 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
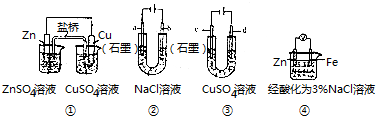
| A. | 装置①中,盐桥(含有琼胶的KCl饱和溶液)中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段时间后,a极附近溶液的pH减小 | |
| C. | 用装置③精炼铜时,c极为纯铜 | |
| D. | 装置④中电子由Zn流向Fe,装置中有Fe2+生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向漂白液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 用氨水吸收足量二氧化硫:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 用足量的氧氧化钠溶液吸收二氧化氮:3NO2+2OH-═2NO3-+NO+H2O | |
| D. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com