
| A、烯烃 | B、烷烃 | C、卤代烃 | D、醇类 |
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
| 微生物 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L的戊烷所含的分子数为0.5NA |
| B、26g乙炔所含共用电子对数目为2NA |
| C、标准状况下,11.2L CCl4所含分子数为0.5NA |
| D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯与溴水混合振荡,水层颜色变浅 |
| B、裂化汽油与溴水混合振荡,水层颜色变浅 |
| C、乙烯与水在一定条件下反应制取乙醇 |
| D、乙炔与氯化氢在一定条件下反应制取氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
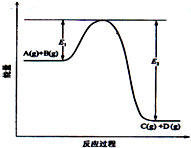 反应A(g)+B(g) 错误!未找到引用源C(g)+D(g)过程中的能量变化如图所示,请回答下列问题:
反应A(g)+B(g) 错误!未找到引用源C(g)+D(g)过程中的能量变化如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 高温 |
| 气体 | SO2 | O2 | SO3 |
| 物质的量(mol) | 1.6 | 1.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C |
| B、C和S |
| C、KNO3 |
| D、S和KNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com