
分析 在一密闭的2L容器中装有4mol SO2和2mol O2,2min末测得容器中有0.8mol/L×2L=1.6mol SO2,则:
2SO2(g)+O2(g)?2 SO3(g)
起始量(mol):4 2 0
变化量(mol):2.4 1.2 2.4
2min末(mol):1.6 0.8 2.4
(1)根据c=$\frac{n}{V}$计算SO3的浓度;
(2)根据v=$\frac{△c}{△t}$计算v(SO3);
(3)SO2的转化率=$\frac{转化的量}{起始的量}$×100%.
解答 解:在一密闭的2L容器中装有4mol SO2和2mol O2,2min末测得容器中有0.8mol/L×2L=1.6mol SO2,则:
2SO2(g)+O2(g)?2 SO3(g)
起始量(mol):4 2 0
变化量(mol):2.4 1.2 2.4
2min末(mol):1.6 0.8 2.4
(1)2min末SO3气体的物质的量浓度为$\frac{2.4mol}{2L}$=1.2 mol/L,
答:2min末SO3气体的物质的量浓度为1.2mol/L;
(2)2min内O2的平均反应速率v(O2)为$\frac{\frac{1.2mol}{2L}}{2min}$=0.3 mol/(L.min),
答:2min内O2的平均反应速率v(O2)为0.3mol/(L.min);
(3)2min末SO2的转化率为$\frac{2.4mol}{4mol}$×100%=60%,
答:2min末SO2的转化率为60%.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法及反应速率公式、转化率计算等为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1的醋酸溶液中加水或通入HCl气体都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | 0.1mol•L-1的醋酸钠溶液20mL与0.1mol•L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 | |
| D. | 0.1mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
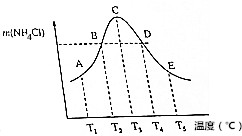 ( )
( )| A. | 不同温度下的平衡常数K3<K4<K5 | |
| B. | 正反应速率:vB=vD | |
| C. | 当体系气体的平均相对分子质量不再改变时,不能说明反应达到平衡状态 | |
| D. | A、B、D、E点均未达到平衡状态,C点达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (2)乙炔的结构式H-C≡C-H
(2)乙炔的结构式H-C≡C-H查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:H2X<YH3<ZH4 | |
| B. | 最高价氧化物对应的水化物酸性:H2XO4>H3YO4>H2ZO3 | |
| C. | 元素的最高正化合价:X>Y>Z | |
| D. | 元素原子的半径:X<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78g苯含有C=C双键的数目为3NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 6.72L NO2与水充分反应转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对原子质量和电子数 | B. | 电子层数和最外层电子数 | ||
| C. | 电子层数和次外层电子数 | D. | 相对原子质量和最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸中H2SO4的电离方程式:H2SO4+2CH3COOH=SO42-+2CH3COOH2+ | |
| B. | H2SO4的冰醋酸溶液中:c(CH3COOH2+)=c(HSO4-)+2c(SO42-)+c(CH3COO-) | |
| C. | 浓度均为0.1mol•L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3) | |
| D. | 向HNO3的冰醋酸溶液中加入冰醋酸,$\frac{c(C{H}_{3}COO{{H}_{2}}^{+})}{c(HN{O}_{3})}$减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com