
【题目】一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的c(H+)=0.1 mol·L-1。下列叙述不正确的是( )
A. 反应中共消耗1.8 mol H2SO4B. 气体甲中SO2与H2的体积比为4∶1
C. 反应中共消耗97.5 g ZnD. 反应中共转移3 mol电子
【答案】B
【解析】
Zn和浓硫酸发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,随着反应的进行,溶液浓度减小,
稀硫酸与Zn发生:Zn+ H2SO4(稀)=ZnSO4+H2↑,则生成的气体为SO2和的H2混合物,根据反应的有关方程式结合质量守恒定律列方程组计算。
生成气体的物质的量为![]() =1.5mol,溶液剩余硫酸的物质的量为
=1.5mol,溶液剩余硫酸的物质的量为![]() ×1L×0.1mol/L=0.05mol,
×1L×0.1mol/L=0.05mol,
参加反应的n(H2SO4)=0.1L×18.5mol/L-0.05mol=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,
设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+ H2SO4(稀)=ZnSO4+H2↑
y y y
x+y=1.5
2x+y=1.8
解之得 x=0.3,y=1.2
所以反应会生成0.3mol的二氧化硫和1.2mol的氢气。
A.由以上计算可知,反应中共消耗1.8mol H2SO4,故A正确;
B.气体A为SO2和H2的混合物,且V(SO2):V(H2)=1:4,故B错误;
C.反应中共消耗金属Zn的质量m(Zn)=(0.3mol+1.2mol)×65g/mol=97.5g,故C正确;
D.在反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O 中,生成0.3mol的二氧化硫转移电子为0.6mol,反应Zn+ H2SO4(稀)=ZnSO4+H2↑中,生成1.2mol氢气转移电子2.4mol,所以反应中共转移3mol电子,故D正确。
故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是常用的定影剂、还原性分析试剂。Na2S2O3·5H2O是无色晶体,易溶于水,不溶于乙醇,在潮湿的空气中易潮解,Na2S2O3和甲醛能形成难被碘溶液氧化的化合物。甲、乙两个兴趣小组用下列装置在实验室制备硫代硫酸钠。

回答下列问题:
(1)仪器a的名称是____________;溶液1是____________。
(2)甲小组按上图连接好装置,打开K1、K3,关闭K2,打开仪器a的活塞;片刻后,打开集热式磁力搅拌器加热;将气体通入锥形瓶中,溶液出现黄色浑浊后逐渐消失,相关的化学反应方程式为:①_________________;②Na2SO3+S![]() Na2S2O3。
Na2S2O3。
(3)加热浓缩至出现少量晶膜,停止加热,打开K2,关闭K3,用注射器注入无水乙醇后有大量晶体析出。加入乙醇的作用是__________________________________。
(4)乙小组在制备Na2S2O3时进行了改进。将C装置中的溶液换为Na2CO3和Na2S混合液,其反应为:Na2CO3+Na2S+4SO2=3Na2S2O3+CO2。配制该混合溶液的过程中,先将Na2CO3完全溶解,再将Na2S溶解于Na2CO3的溶液中,其目的是__________________。
(5)测定乙小组产品纯度。取3.000gNa2S2O3·5H2O晶体,配成100mL溶液,取20.00mL于锥形瓶,调节溶液的pH至6,加入适量甲醛溶液和Zn(CH3COO)2溶液,过滤,洗涤,在滤液中滴加几滴淀粉溶液,用0.1000mol/L标准碘溶液滴定,消耗标准碘溶液10.00mL。
①加入适量甲醛溶液和Zn(CH3COO)2溶液的目的是_________________________________。
②该产品中Na2S2O3·5H2O的质量分数为_____________。 (已知:2Na2S2O3+I2=Na2S4O6+2NaIKsp(ZnS)=1.6×10-24 M(Na2S2O3·5H2O)=248g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是
A. 浓硝酸保存在棕色玻璃试剂瓶中,且要用橡胶塞密封好。
B. 少量的钠保存在煤油中
C. 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中
D. 新制的氯水通常保存在棕色玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中所示物质或概念间的从属关系符合下圈的是
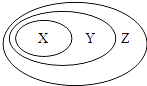
X | Y | Z | |
A | 钠元素 | 主族元素 | 短周期元素 |
B | 电解质 | 化合物 | 纯净物 |
C | 氢氧化铁 | 分散系 | 胶体 |
D | 置换反应 | 氧化还原反应 | 放热反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol·L-1 的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A. 开始加入合金的质量可能为16.4g
B. 标准状况下产物NO的体积为22.4L
C. 生成沉淀完全时消耗NaOH溶液的体积为100mL
D. 参加反应的硝酸的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是几种常见的加热装置。

请回答下列问题:
(1)A、B、C、D四种装置都是用酒精灯直接加热,E、F装置加热时需垫上________。其中F装置中对试管的加热方式是_____________________________,使用这种加热方式的目的是______________________。
(2)用H2还原CuO可选用____________(填字母,下同)装置。
(3)加热NH4Cl与Ca(OH)2的固体混合物制NH3可选用___________装置。
(4)胆矾中结晶水含量的测定可选用_______装置。
(5)乙酸乙酯的制备可选用____________装置。
(6)MnO2与浓盐酸混合制Cl2可选用_____装置。若该装置只加热液体时,受热容器内必须放____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的叙述,正确的是( )
A. 非金属元素原子之间形成的一定是共价键
B. 离子化合物中一定含有离子键
C. 单质分子中一定存在化学键
D. 含有共价键的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是( )
A.浓硝酸保存在棕色试剂瓶中并放置在阴凉处
B.少量的金属钠保存在煤油中
C.液溴应保存在棕色细口瓶,并加水液封
D.新制的氯水通常保存在无色玻璃试剂瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com